近年来,胞外囊泡(EV)逐渐被广泛用作众多疾病生物学标志物的采集来源。胞外囊泡是包括外泌体(exosome)、微泡(microvesicle)和凋亡小体(apoptoticbody)在内的一系列膜囊泡,其直径约为30-2000纳米不等。大多数细胞类型都可以分泌胞外囊泡到血液循环中,也就意味着它们把富含了大量细胞来源的RNA、蛋白质或代谢产物转载进入循环。此外,胞外囊泡可以携带一批与疾病有关的遗传信息,在被受体细胞“内吞”保持生物活性后,可以调节细胞功能。
为了发挥胞外囊泡作为生物标志物的全部潜力,医学研究领域不仅需要能够“探测”胞外囊泡的工具,而且迫切渴望有效分离特定胞外囊泡子集,并且在分子水平上进一步研究评估其所包含物质的创新研究技术。
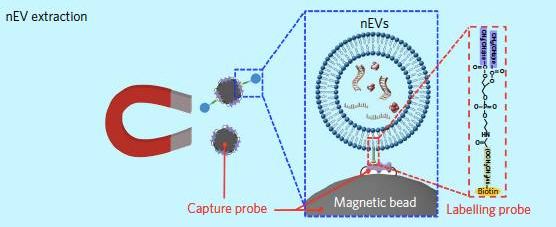
▲标记探针和捕获探针协助分离纳米胞外囊泡
近日,《自然》子刊《NatureBiomedicalEngineering》上的一篇论文中,来自南京大学和宾夕法尼亚州立大学(PennsylvaniaStateUniversity)的科学家们报道了一种新颖的脂质纳米探针方法,可以快速、经济且高效地分离纳米级的胞外囊泡(nEV),并能够从非小细胞肺癌患者体内分离的纳米胞外囊泡(nEV)里面识别相关遗传突变。
正因为胞外囊泡可以通过在细胞之间“转运”蛋白质和核酸物质来介导细胞间通讯,针对这一微小细胞来源物的研究正如火如荼地开展,但绝大多数研究受到纳米胞外囊泡(nEV)分离技术能力的巨大挑战。宾夕法尼亚州立大学和南京大学的团队所开发的上述脂质纳米探针系统可以在15分钟内自发标记nEV,并且用于随后的磁力富集。
这一创新简易技术所达到的隔离效率和收集物组成类似于现有超速离心方法,但超速离心方法的速度慢很多,也需要大型仪器来实现。他们的数据结果还表明,这种方法允许对核酸和蛋白质进行下游分析,从而能够在从非小细胞肺癌患者的血浆中分离出nEV之后,进一步鉴定EGFR和KRAS突变。
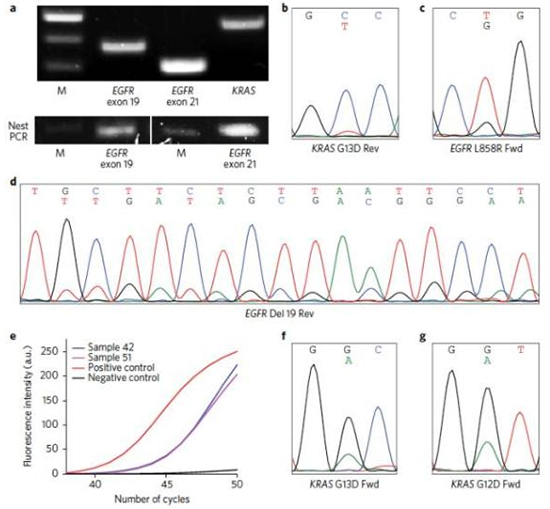
▲研究人员从非小细胞肺癌患者血浆中分离出nEV鉴定EGFR和KRAS突变
在具体步骤中,研究作者的分离方法采用生物素标记的聚乙二醇链和二酰基脂质尾作为标记探针、NeutrAvidin(生物素)涂层的磁亚微米颗粒作为捕获探针。首先,通过将脂质尾部锚定到nEV膜中,使得标记探针与nEV结合,然后将nEV固定在磁性颗粒上,最后可以通过施加磁场来分离nEV。分离程序仅需15分钟,并具有与长时间标准超离心方案相似的捕获效率。
此外,作者还表明,通过用与生物素相比具有较低亲和力的脱硫生物素标记探针,他们可以通过用生物素置换的方法从探针中收获nEV,并且收获的nEV维持了其生物功能。接下来,研究人员从捕获的nEV中提取和分析核酸和蛋白质。在基因组学、转录组学和microRNA分析的基础上,数据表明通过脂质纳米探针分离的nEV的物质组成与通过超速离心法分离的nEV的组成相当。
最终,研究人员们成功确定了从非小细胞肺癌患者分离的血浆衍生的nEV遗传物质中的DNA突变。
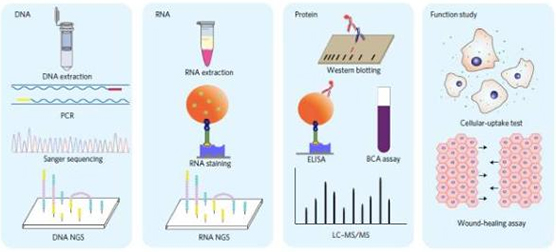
▲这一创新方法可适用于众多下游操作(图片来源:《NatureBiomedicalEngineering》)
我们很高兴看到纳米技术在胞外囊泡检测检验工程中的有效应用,并且期望纳米探针的效率和多功能性方法在癌症诊断护理中开辟众多机会,造福肿瘤患者。





 浙公网安备33010802007965号
浙公网安备33010802007965号