m5C调控mRNA出核
中国科学院北京基因组研究所精准基因组医学重点实验室及遗传与发育协同创新中心杨运桂研究组和郑州大学第一附属医院生殖与遗传专科医院孙莹璞研究组、中国科学院生态环境研究中心汪海林研究组合作研究,揭示了m5C(5-甲基胞嘧啶)修饰在mRNA的分布图谱规律及其对调控mRNA出核作用新机制。该研究成果以5-methylcytosinepromotesmRNAexport--NSUN2asthemethyltransferaseandALYREFasanm5Creader为题,于4月18日在《细胞研究》(CellResearch)杂志发表。
研究团队首先建立改进的RNAm5C单碱基分辨率高通量测序与生物信息分析技术,揭示了mRNAm5C的分布规律,并绘制了精细的m5C修饰图谱,发现m5C在mRNA的翻译起始位点下游有显著富集,并且主要分布于CG富集区域。
通过分析对比人和小鼠不同组织,发现m5C在mRNA上的分布特征在哺乳动物中十分保守,而在不同组织中修饰的基因具有特异性。研究团队同时发现,在小鼠睾丸发育过程中,动态的m5C修饰基因显著富集于精子发育相关功能,提示m5C修饰参与生殖发育调控。
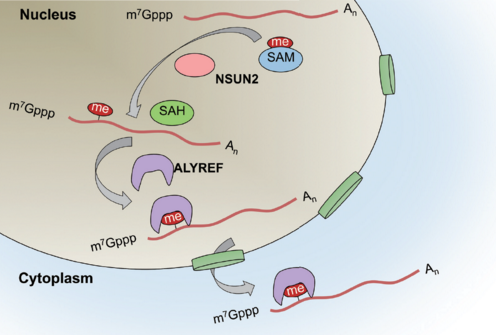
在获得精细的RNAm5C单碱基分辨率修饰图谱后,研究团队发现NSUN2蛋白是主要的mRNAm5C甲基转移酶,其活性依赖于C271和C321位点,且NSUN2功能缺失导致mRNA的出核受到抑制。通过进一步的研究发现,出核调控蛋白ALYREF通过第171位赖氨酸特异性结合m5C修饰位点,从而促进mRNA出核。
至此,研究团队发现了mRNAm5C主要甲基转移酶NSUN2(Writer)及其第一个结合蛋白ALYREF(Reader),并揭示了m5C调控mRNA出核的重要功能。
RNA甲基化是表观转录组调控的一种重要形式,对RNA转录后调控以及恶性肿瘤等相关疾病的诊断和治疗有重要意义。
杨运桂研究团队一直致力于该领域的研究,参与发现了RNA甲基化修饰m6A相关酶(Jiaetal.NatureChemicalBiology2011;Zhengetal.MolecularCell2013;Pingetal.CellResearch2014)及其甲基化位点选择性机制(Chenetal.CellStemCell2015)和m6A修饰外显子被保留现象(Zhaoetal.CellResearch2014),m6A结合蛋白YTHDC1(Xiaoetal.MolecularCell2016)和YTHDF3(Lietal.CellResearch2017)分别调控mRNA剪接和翻译机制,阐明了mRNAm5C修饰规律、甲基转移酶和结合蛋白及其调控mRNA出核机制。
本次发表的研究成果将为进一步研究RNA甲基化调控的生物功能和RNA表观遗传提供依据,为研究与正常生理或异常病理生命活动关联分子机理提供新的表观调控研究方向。
该项研究得到科技部、国家自然科学基金和中科院先导等项目的支持。





 浙公网安备33010802007965号
浙公网安备33010802007965号