肿瘤免疫疗法是近几年的热点,以PD-1/PD-L1为代表的肿瘤免疫治疗药物给多种难治性肿瘤都带来了临床获益。目前上市的5个anti-PD-1/PD-L1单抗药物(Opdivo、Keytruda、Tecentriq、Bavencio、Imfinzi)也一直是行业和媒体关注的焦点。
事实上,除了PD-L1之外,PD-1还有另外一个配体PD-L2。不管是PD-L1,还是PD-L2,一旦与PD-1结合,就会使T细胞的功能受到抑制,变得“无能”,从而让肿瘤细胞逃脱了免疫系统的追杀。因此PD1抑制剂的作用主要是解除肿瘤患者的免疫抑制状态,恢复免疫系统对肿瘤细胞的杀伤作用。
如下图所示,PD-1主要表达在免疫细胞上,PD-L1表达在免疫细胞和肿瘤细胞上,而PD-L2主要表达在免疫细胞上。总体来看,PD-L2相比于PD-L1的表达范围更窄一些。
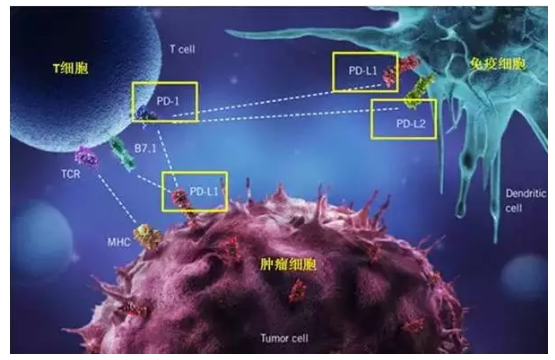
理论上讲,PD-1单抗可以跟T细胞上的PD-1蛋白结合,所以可以同时阻断PD-1与PD-L1、PD-L2的结合;而PD-L1单抗只能和PD-L1结合,所以只能阻断PD-1与PD-L1的结合,不能阻断PD-1跟PD-L2的结合,所以使用PD-L1抗体意味着T细胞还可能被PD-1/PD-L2通路抑制。
PD-L1的表达水平与PD-1/PD-L1类药物的临床疗效密切相关,最经典的案例当属Opdivo与Keytruda在竞争NSCLC一线疗法时,对患者PD-L1表达水平的限定成为左右战局胜负的关键,大家对这个故事已经相当熟悉,不再过多介绍(见:爆冷!Opdivo一线治疗非小细胞肺癌III期研究失败,BMS输掉与MSD的天王山之战!)。
近日,来自MerckResearchLaboratories的科学家近日在《临床癌症研究杂志》(IF9.619)发表了一篇题为《PD-L2ExpressioninHumanTumors:RelevancetoAnti-PD-1TherapyinCancer》的文章(DOI:10.1158/1078-0432)。他们发现PD-L2的表达水平与PD-1单抗Keytruda(pembrolizumab)治疗头颈部鳞状细胞癌(HNSCC)的临床疗效密切相关。
该研究的第一作者JenniferYearley是来自MerckResearchLaboratories的组织病理学专家。她评论称:“目前发表的研究主要是关注PD-L1在肿瘤中的表达分布以及其对药物临床疗效的关系。我们开发了一种高特异性、高灵敏度的检测PD-L2在不同肿瘤中表达水平的检测方法,并评估了PD-L2表达水平与pembrolizumab治疗HNSCC临床疗效的关系”。
研究人员采用具有创新性的免疫组织化学方法分析了超过400份存档肿瘤组织样本,涉及7种不同肿瘤类型,包括肾细胞癌、膀胱癌、黑色素瘤、非小细胞肺癌、三阴乳腺癌、胃癌、HNSCC,结果发现PD-L2在不同肿瘤中的表达情况差异巨大。
在肾细胞癌组织样本中,未见一个肿瘤细胞表达PD-L2。在黑色素瘤组织样本中,只有极少数肿瘤细胞表达PD-L2。在胃癌、三阴乳腺癌中,PD-L2的表达水平中等或有所升高,而在HSNCC组织样本中,超过一半的肿瘤细胞都表达了PD-L2。
基于这个发现,研究人员对KEYNOTE-012研究中172例接受pembrolizumab治疗的复发或转移性HNSCC患者的组织样本进行了回顾性分析,发现PD-L1和PD-L2表达均为阳性的患者的ORR为27.5%,PD-L1表达阳性而PD-L2表达阴性的患者ORR仅为11.4%,前者是后者的2倍,提示同时抑制PD-L1和PD-L2可能会提高临床应答率。此外,PD-L2表达阳性患者的mPFS和mOS都要长于PD-L2表达阴性的患者,这种预测作用独立于PD-L1的表达情况。
作者指出,这个研究结果表明,PD-L2的表达水平可以作为补充信息,和PD-L1的表达水平一起作为预测anti-PD1疗法临床疗效的检测指标。
Yearley目前还在开展其他研究,包括评估PD-L2联合PD-L1、其他免疫相关分子标记物对药物临床疗效的相关性。





 浙公网安备33010802007965号
浙公网安备33010802007965号