在一项新的研究中,来自美国劳伦斯伯克利国家实验室、加州大学伯克利分校和阿尔伯特-爱因斯坦医学院的研究人员提供证据证实作为DNA中的一个不同寻常的部分,异染色质利用液-液相分离(liquid-liquidphaseseparation)将基因组中的大部分组装成细胞核中的特定区域。
图片来自Amy Strom/Berkeley Lab
液-液相分离是一种在物理学上广为人所知的机制,但是它在生物学上的重要性仅在最近才被揭示出。这些发现解决了一个长期存在的问题,即DNA功能如何在空间和时间上有序地安排,包括基因如何受到调节而发生沉默或表达。相关研究结果于2017年6月21日在线发表在Nature期刊上,论文标题为“Phaseseparationdrivesheterochromatindomainformation”。
论文通信作者、劳伦斯伯克利国家实验室生物系统与工程系高级科学家GaryKarpen说,“几十年来,DNA序列在健康和疾病中的重要性是清晰的,但是我们仅在最近才意识到将DNA片段组装成细胞核内的不同结构域或者区室对促进不同的基因组功能是至关重要的。”
异染色质中的长片段DNA含有在大多数情况下需要被沉默的序列,这样细胞才能够正确地发挥作用。科学家们曾经认为DNA的这种压缩是控制哪些酶和分子接触到这些序列的一种主要机制。据推断,DNA链缠绕得越紧,接触到内部的遗传物质就变得越难。
近年来,因为发现一些大的蛋白复合体能够接触到这种异染色质结构域,然而较小的蛋白不能够接触到它,所以这种机制备受质疑。
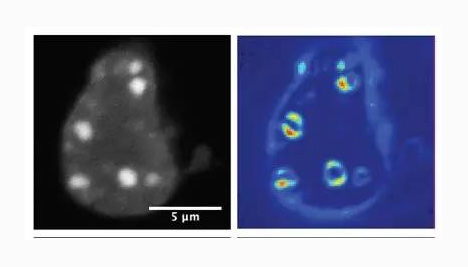
在这项以早期的果蝇胚胎和小鼠细胞为实验对象的新研究中,这些研究人员观察到细胞核中的两种不能混合在一起的液体:一种液体含有已表达的基因,另一种液体含有沉默的异染色质。他们发现异染色质液滴像两滴被水包围的油那样融合在一起。
在实验室实验中,这些研究人员纯化出一种异染色质的主要组分,即异染色质蛋白1a(heterochromatinprotein1a,HP1a),并且观察到通过形成液滴,这种组分能够再现他们在细胞核中观察到的情形。
论文第一作者、Karpen实验室研究生AmyStrom说,“我们对这些发现感到兴奋,这是因为它们解释这个领域存在了十年的一个秘密。这就是如果这种压缩控制对沉默序列的接触,那么其他大的蛋白如何仍然能够接触到它呢?利用将蛋白靶向一种液体或另一种液体的相分离方法进行的染色质组装并不是基于大小,而是基于其他的物理特性,如电荷、灵活性和相互作用对象。”
在另一项同期发表在Nature期刊上的标题为“LiquiddropletformationbyHP1αsuggestsaroleforphaseseparationinheterochromatin”的研究中,美国加州大学旧金山分校的研究人员证实人HP1a蛋白具有同样的液滴性质,这提示着类似的原则也适用于人异染色质。
令人关注的是,这种液-液相分离对温度变化、蛋白浓度和pH值非常敏感。
Strom说,“对细胞能够同时操纵很多序列的基因表达而言,这是一种优雅的方式。”
其他的细胞结构,包括一些参与疾病的细胞结构,也是通过相分离进行组装的。
Karpen说,“相分离问题与痴呆症和某些神经退行性疾病等疾病相关联。”
Karpen注意到,随着我们变老,生物学分子丢失了它们的液态,变得更加刚性,并且在此过程中积累损伤。他指出在阿尔茨海默病和亨廷顿舞蹈病等疾病中,蛋白发生错误折叠和聚集,在一段时间之后逐渐丢失它们的液态,变得更加刚性。
Strom补充道,“如果我们能够更好地理解是什么导致聚集,如何增加其液态,那么我们可能有机会抵抗这些疾病。”
这项研究是理解DNA如何发挥功能取得的一项重大进展,而且也可能有助改善人们操纵基因的能力。
Karpen说,“基因疗法,或者任何依赖基因表达严格调控的疗法,可能通过将分子准确地靶向运送到细胞核中的合适位置加以改进。靶向位于异染色质中的基因是非常困难的,而且这种对相分离和液体行为相关的性质的理解可能有助改变这种情形,并且让我们能够操纵之前不能够操纵的三分之一的基因组。”





 浙公网安备33010802007965号
浙公网安备33010802007965号