泌体标志物(非编码RNA,蛋白)与疾病诊断、外泌体在液体活检领域的应用
第一代EGFR-TKIs获得性耐药的患者使用组合的外泌体RNA和循环肿瘤DNA方法检测血浆EGFR突变
KrugAK,KarlovichC,KoestlerT,etal.AbstractB136:PlasmaEGFRmutationdetectionusingacombinedexosomalRNAandcirculatingtumorDNAapproachinpatientswithacquiredresistancetofirst-generationEGFR-TKIs[J].AnnalsofInternalMedicine,2015,14(12Supplement2):B136-B136.
于AnnalsofOncology杂志(IF11.854)的研究中,研究人员分析了来自IIIB和IV期NSCLC患者参加TIGER-X试验(第三代EGFR抑制剂rociletinib的1/2期临床试验,编号NCT01526928)的84个血浆样品。研究人员分离外泌体和ctDNA,并提取核酸,并使用有针对性的NGS分析(EXO1000)来筛选EGFR突变。该研究的主要目的是检测同时提取exoRNA和ctDNA是否会增加拷贝数和EGFR突变检测的敏感性,尤其是在通过肿瘤活组织检查已知EGFR突变阳性的患者中,不通过只单独的分析ctDNA鉴定EGFR突变检测。研究人员将数据与匹配的组织数据进行比较,并匹配先前用BEAMing获得的ctDNA结果。此外他们通过分析治疗15天后收集的血浆,检测了治疗期间EGFR突变水平的变化是否与治疗结果相关。
2018(第三届)外泌体与疾病研讨会
研究结果发现,对于exoNA(exoRNA和cfDNA二者的组合),检测EGFR激活突变的灵敏度为98%,EGFRT790M为90%。BEAM对ctDNA的敏感性分别为82%,T790M为84%。在一胸内转移亚组患者中(M0/M1a;n=21),利用exoNA的检测,EGFR激活突变的检测灵敏度从26%上升到74%(p=0.003),T790M的灵敏度从19%上升到31%。综上所述,exoRNA和ctDNA的联合检测增加了血浆中EGFR突变检测的敏感性,并在已知具有低水平ctDNA的M0/M1a患者中看到检测的改善,该方法也对于仅基于ctDNA的突变检测提出了新的挑战。
外泌体作为药物递送载体
JiangXC,GaoJQ.Exosomesasnovelbio-carriersforgeneanddrugdelivery[J].InternationalJournalofPharmaceutics,2017,521(1–2):167-175.
浙江大学的Jiang等人综述了外泌体作为新型药物载体的近期实验室研究。
由于缺乏适当的治疗性输送系统,临床治疗在某些疾病中停滞不前。最近的研究已经确定了外泌体作为无细胞疗法的潜在用途,这可能为解决疾病的问题提供了一种新的机制。外泌体是纳米级细胞外囊泡,其可以运输富含蛋白质,脂质,DNA和RNA。人们越来越认识到,外泌体不仅在生理条件方面,而且在病理方面都起着复杂的作用。越来越多的证据表明,外泌体在远距离的细胞间通讯中是至关重要的,因为它们可以在分泌时进入循环,并通过额外的生物屏障。因此,对外泌体的功能参数及其作为小分子治疗的递送载体的潜在应用的兴趣已经爆炸。在这篇综述中,我们讨论了外泌体作为“天然纳米粒子”来传递药物和基因的潜力,并将它们的优缺点与其他传递机制进行了比较。
Nature子刊:外泌体miR-21成为神经性疼痛的治疗靶点
伦敦国王学院的一项新研究揭示了神经病理性疼痛中神经元和免疫细胞之间未曾发现的细胞通讯机制。研究人员发现了一种治疗小鼠神经性疼痛的新方法,与目前含有阿片类药物和抗癫痫药物的治疗相比,这种方法更为安全有效。
神经性疼痛是一种通常由神经损伤引起的慢性疼痛,但在损伤愈合后疼痛持续很久。神经性疼痛可能发生在手术或车祸后,或在某些情况下肢体被截肢。目前唯一可用于神经性疼痛的药物是阿片类药物或抗癫痫药物。
他们发现神经损伤后,该区域的疼痛神经元释放出含有microRNA-21的非常小的生物颗粒(外泌体)。然后这些颗粒被周围的免疫细胞吸收,最终导致局部炎症和神经性疼痛。作者表示,当他们阻断背根神经节疼痛神经元释放外泌体中的miRNA-21时,在细胞水平上具有抗炎作用,并可在体内防止小鼠发生神经性疼痛。这种方法的优点是,这些含有阻断miRNA-21的物质的颗粒不会渗入大脑,导致副作用。
用外泌体修补“破碎”的心脏
DoughertyJA,MergayeM,KumarN,etal.PotentialRoleofExosomesinMendingaBrokenHeart:NanoshuttlesPropellingFutureClinicalTherapeuticsForward[J].StemCellsInternational,2017,2017(7):1-14.
干细胞移植治疗是一种很有前景的修复损伤心脏组织并使其再生的辅助手段;然而,由于缺血心脏中移植细胞的存活不佳,一般仅能观察到心脏功能的适度改善。因此,对于可以帮助减轻心脏损伤的新疗法亟待出现。最近的研究已经证明干细胞释放的外泌体可以作为心脏修复的潜在的无细胞治疗剂。曾经一度被认为仅仅是一种细胞废物的外泌体或细胞外纳米粒子已被证明在包括短距离和长距离的细胞间通讯在内的生理功能中起着至关重要的作用。
近日,来自俄亥俄州立大学Wexner医学中心的研究人员概述了一些研究,这些研究证实了外泌体在改善心脏功能、减轻心脏纤维化、刺激血管生成和调节miRNA表达方面有潜在作用。此外,外泌体携带重要的miRNA和蛋白质货物,可以作为心肌梗塞后心血管疾病的诊断标志物并发挥重要作用。虽然有临床前研究的证据表明,干细胞释放的外泌体可以作为心肌修复的潜在无细胞治疗剂,但目前将外泌体完全用作心脏修复治疗剂之前还是有很多核心问题需要解决。
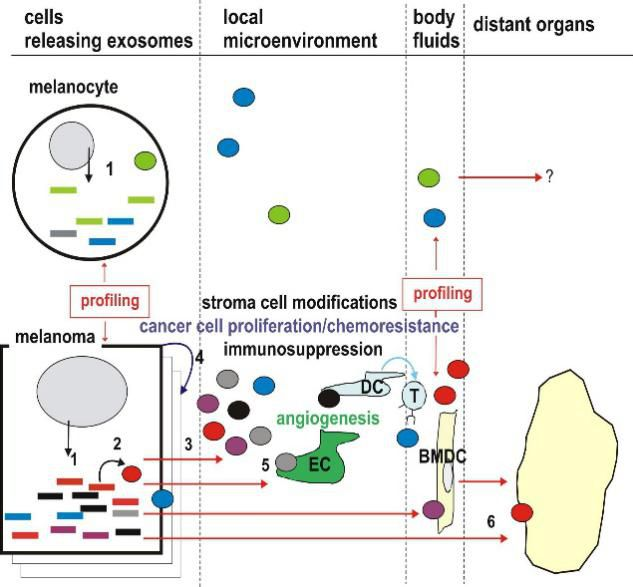
已经发现外泌体exosomes在心脏修复中起关键作用。这些纳米粒子可以通过miRNA直接调控基因表达,将信息传递给靶细胞。图中列出的外泌体是被发现在从各种细胞系分离的表达上调的外泌体,并且这些外泌体具有心脏保护作用。已有研究显示在急性心肌梗塞(AMI)后施用于小鼠来源对间充质干细胞(MSCs)、心脏祖细胞(CPCs)、胚胎干细胞(ESC)和心肌源性细胞(CDCs)的外泌体可增强心脏功能、血管生成、减弱细胞凋亡和纤维化。
外泌体技术:快速从血液样品中分离外泌体
WuM,OuyangY,WangZ,etal.Isolationofexosomesfromwholebloodbyintegratingacousticsandmicrofluidics.[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2017:201709210.
近日,麻省理工学院(MIT)和杜克大学(DukeUniversity)的研究人员在《PNAS》上发表文章,他们开发了一种新型设备,能利用声波技术,快速从血液样品中分离外泌体(exosome)。在精准医疗时代,这项技术可能在未来的疾病诊断和治疗中发挥重要作用。
外泌体是细胞分泌的一种纳米级别的小囊泡,直径约为30至150纳米,它们携带重要的信息,包括蛋白质、miRNA等,帮助细胞之间通信。以前的研究表明,外泌体内容物可以作为诸如癌症,神经变性疾病和肾脏疾病等疾病的标志物。尽管它对疾病诊断非常重要,但现有的外泌体分离方法需要高速离心。它需要使用大型机器,耗费近24小时的时间才能获得,非常不便。而高离心力也可能破坏囊泡。降低样品的质量。
这项研究有望解决这一难题。在论文中,研究人员们提供了一种通过微流体和声学的独特组合从体液样品中捕获外泌体的新颖方法。这种方法分离得到的外泌体,基本上不改变其生物或物理特征,为开发评估人类健康以及疾病诊断和进展提供了有吸引力的新方法。
他们开发的原始声学分选装置由两个倾斜的声学换能器和一个微流体通道组成。当这些传感器产生的声波相互碰撞时,它们形成产生一系列压力节点的驻波。它原本被用于分选细胞——每当细胞或颗粒流过通道并遇到一个节点时,压力会将细胞引导离开中心一点点。细胞移动的距离取决于大小和其他属性(如可压缩性),这样,在到达通道末尾时,不同大小和性质的细胞就能够被分离开来。
为了分离外泌体,研究人员用两个这样的单元串联构建了一个装置。首先,使用声波从血液样品中除去细胞和血小板。一旦细胞和血小板被去除,样品进入第二个微流体单元,然后使用较高频率的声波将外泌体与稍大的细胞外囊泡分开。
这项工作的通讯作者之一,麻省理工学院材料科学与工程系科学家MingDao博士说:“声波更温和。而且在分离时,这些囊泡受处理的时间只有1秒钟或更短。这是一个很大的优势。”使用该设备,处理100微升未稀释血液样本只需要不到25分钟。
研究人员们表示,这种新技术为研究“液体活检”增添一个新的维度,并促进细胞外囊泡的临床应用,以了解难以进入的器官(例如人类怀孕期间的胎盘)的生理和健康。“这种新技术可以解决当前外泌体分离技术的缺点,如周期长,一致性差,产量低,污染以及完整性受损等。我们想要把提取高质量的外泌体的过程简化为按一个按钮就在10分钟内获得所需样品一样简单。”研究人员们说。
外泌体研究是多个生物医学领域的热点方向,这个技术为我们提供了另一个了解疾病的手段,也将使未来的精准医学更加便捷。





 浙公网安备33010802007965号
浙公网安备33010802007965号