肝脏葡萄糖摄入(HGU)异常导致饭后血糖升高,导致一种被称为饭后高血糖的症状。这种异常情况出现在肥胖和2型糖尿病人身上,会导致心血管并发症风险增加。尽管HGU异常的精确机制并不清楚,但是已有证据表明它是由肝脏中葡糖激酶和葡糖激酶调节蛋白(GKRP)异常导致。
图片来源:金泽大学
现在,一个来自日本、由金泽大学HiroshiInoue教授领导的研究团队与国家全球卫生和医学中心的研究人员合作发现一个去乙酰化酶(sirt2)是通过GKRP调节肝葡糖激酶的关键因子,这种机制为治疗2型糖尿病提供了新的潜在疗法。
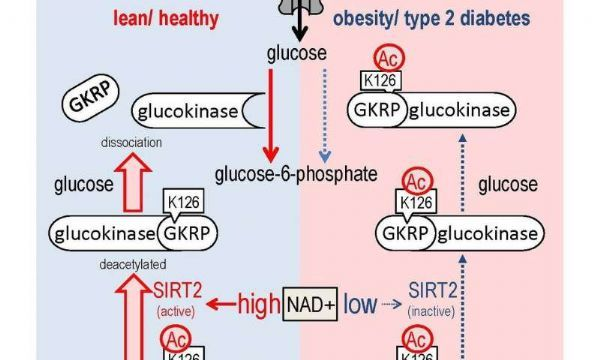
此前报道已经发现信号分子烟酰胺腺嘌呤二核苷酸(NAD+)控制着葡萄糖代谢。在这篇文章中,Inoue及其同事使用体外敲低实验发现sirt2是NAD+依赖性HGU的调节因子。然而sirt2并不影响葡糖激酶和葡萄糖-6-磷酸酶的表达水平,这意味着sirt2通过翻译后修饰影响HGU。
正常细胞中,葡糖激酶会在低血糖时结合GKRP,高血糖时则会解离。但是在糖尿病小鼠中,高血糖时两个蛋白也不会解离。在这项研究中,研究人员发现通过过表达sirt2可以逆转这个过程,sirt2能够直接结合GKRP调节两个蛋白的解离,并且可以以一种NAD+依赖性的方式对GKRP进行去乙酰化修饰。
研究人员也在小鼠身上进行了实验,他们发现表达一种不能被去乙酰化修饰的GKRP后,HGU被扰乱,这表明GKRP乙酰化与HGU和正常血糖维持相关。此外,研究人员还发现NAD+依赖性sirt2活性的降低和sirt2依赖性GKRP乙酰化缺陷部分导致了肥胖糖尿病小鼠身上出现的HGU异常。
总之,研究结果表明NAD+和sirt2调节HGU,sirt2通过GKRP去乙酰化发挥效应。作者总结道:“这些发现表明NAD+/sirt2依赖的GKRP去乙酰化调节在HGU控制中发挥重要作用,这个调节过程是一个治疗2型糖尿病和肥胖的新型治疗靶标。”





 浙公网安备33010802007965号
浙公网安备33010802007965号