写Paper时我们经常说字不如表,表不如图,但小编觉得我们做组学分析经常用到一些图(如热图、网络图等)有的时候也不一定能展示出我们想要目的。
举个例子:如果我们想看检测到的代谢物种类及其含量在样本中的空间分布是怎样的。那这个要如何作图呢?小编最近就看到了一篇能解开这个谜底且非常interesting的文章(IF=17.872),文章题名:Three-Dimensional Microbiome and Metabolome Cartography of a Diseased Human Lung。
鉴于人体器官的大小和异质性以及相关代谢组和微生物组的复杂性,导致科学家现在对整个人体器官的化学和微生物组成空间变化的理解仍然有限,所以该文章的作者们就开发了一个跨越性的研究流程,通过研究囊性纤维化(CF)患者肺代谢组与微生物组,将代谢组学和微生物组数据的制图技术应用到基于放射影像的三维(3D)器官重建中。
研究方法
受试者:
1名41岁男性(囊性纤维化患者)
组织收集前注射抗生素美罗培南2天,注射哌拉西林5天,注射环丙沙星2天;阿奇霉素在组织采集前一个月停止给药。
检测平台:
16s:illumina MiSeq
代谢:UPLC(UltiMate 3000)+ Q-TOF(Maxis)
分析平台:
16s:QIIME v1.9, UCLUST算法
3D肺模型:InVesalius 3.0 , Geomagic Wrap, 'ili-β
Molecular Network:GNPS平台, Cytoscape
Heatmap, pie charts:R包
研究流程
首先从公开的软件InVesalius 3.0中导出CT-扫描图像,然后组合起来创建一个3D肺模型。用3D建模软件Geomagic Wrap除去胸部和背部对应的像素,并一步步清洁模型以显示出完整清晰的人肺部模型。
从肺尖开始每一个组织切片都进一步被细分为1-2cm3的小切片,最终将左肺分成86个切片。通过Google Chrome扩展程序 'ili-β,创建了将组学数据中的丰度映射到这些模型的方法;因为该工具是按照医院肺切片的方向进行的,也即虚拟切片,利用这些虚拟切片和Geomagic Wrap的点坐标特征,获得从切片中切出的每个组织切片的物理x、y和z坐标,这样就可以将测得的对应组织切片的代谢物/微生物丰度映射到模型中对应的部分中,进而在3D模型上展示代谢物/微生物的空间分布。
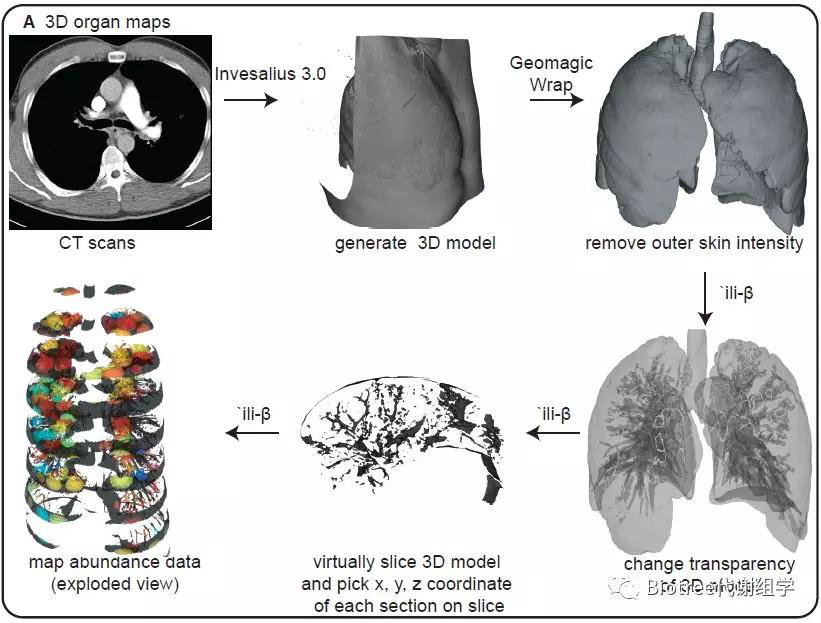
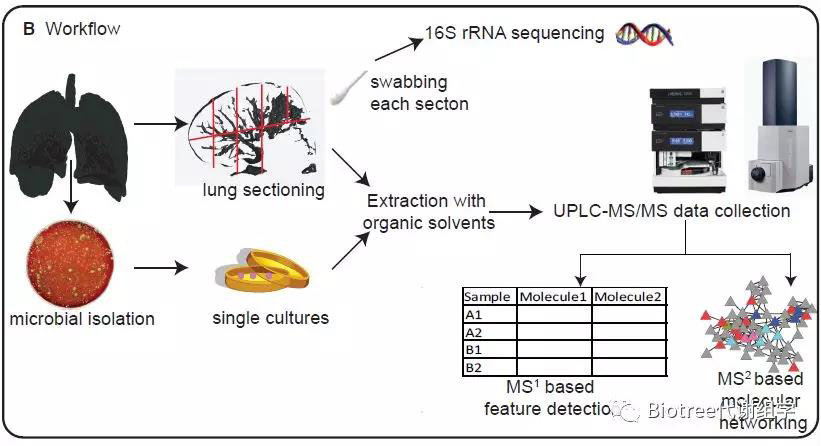
Figure 1. 3D Cartography Workflow for Mapping the Chemistry and Microbiome onto a Radiological Image
(A) The description of the workflow used to create 3D metabolome and microbiome organ maps from the observation matrix.
(B) The description of the workflow used for generating the metabolome and microbiome. (See also Figure S1.)
代谢组
因本研究采用的是终末期CF肺,16s rRNA基因测序和分析发现,该时期假单胞菌占主导地位,且分布在肺部各处(95.8 - 99.9%),而喹诺酮类和鼠李糖脂是假单胞菌产生的毒性因子, 因此通过分离肺部假单胞菌进行培养,再用代谢组学检测体外培养的假单胞菌产生的喹诺酮类和鼠李糖脂,同时也对肺组织中的喹诺酮类和鼠李糖脂进行了检测。
结果显示,在培养的分离物中检测到的喹诺酮类和鼠李糖脂类的多样性较大(分子网络中的蓝绿色节点),而在肺组织中直接检测到的喹诺酮类的多样性较小(橙色节点)。
这些发现强调了小分子在纯培养中的潜在作用与患病器官中生物相关活性之间的脱节,说明这些分子很可能不是在宿主组织中产生、降解、清除或修饰。
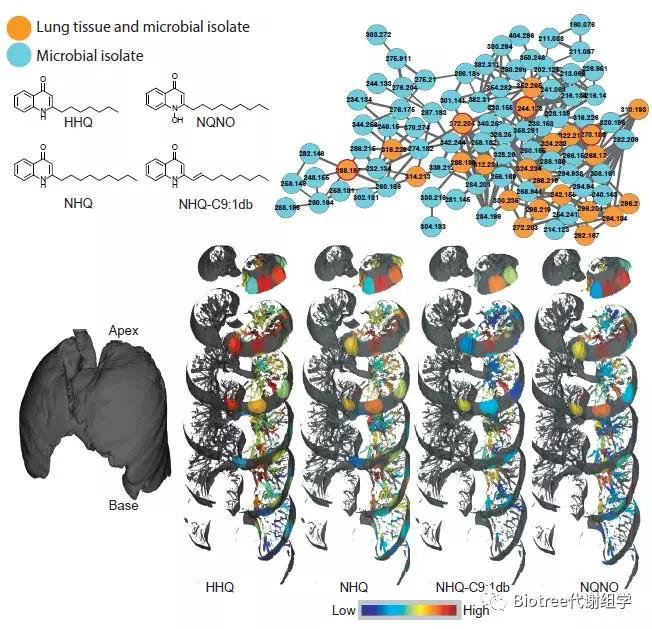
Figure 2. The Molecular Network Corresponding to Quinolones Produced by Pseudomo
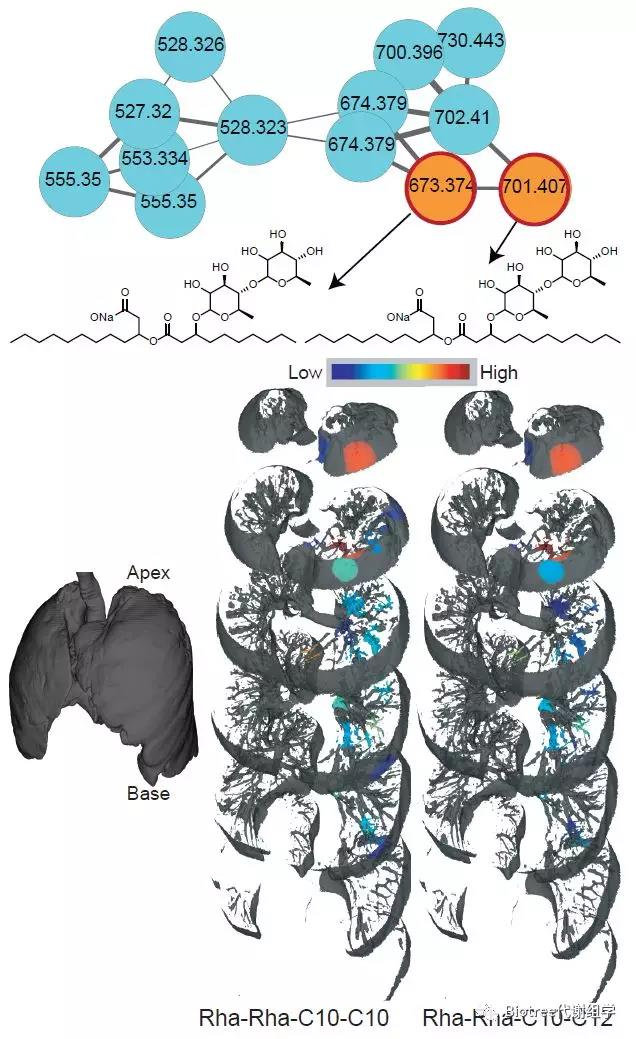
Figure 3. The Molecular Network Corresponding to Rhamnolipids Produced by Pseudo
(橙色节点代表在肺组织和培养的微生物分离物中都检测到的喹诺酮类化合物;蓝绿色的节点是仅在培养的微生物分离物中检测到的喹诺酮类化合物。3D图中在左肺上进行了定位,红色的丰度最高,蓝色的丰度最低,节点内的数字表示m/z。)
为了可视化外源性物质,微生物分子和宿主分子的分布,作者通过质谱检测获得的分子丰度的相对定量生成了肺部3D代谢组学图。属于不同结构类别和来源(宿主、微生物和外来生物)的选择分子的分布如Figure 4所示。
结果显示,结构相关或相似的物质,例如两种三糖,分布特征是相同的;相反,结构不相关的分子分布是有差异的。例如,沙丁胺醇(Albuterol)(一种吸入式的支气管扩张剂)的分布模式与静脉内注射的抗生素则完全不同(Figure 5),这可能提示我们吸入式的药物相对静脉注射的药物来说,在肺组织中并没有那么好的渗透性。
在抗生素渗透性研究中,发现抗生素美罗培南、哌拉西林及其代谢产物去乙基哌拉西林不渗透到肺的底部,而抗生素环丙沙星和阿奇霉素(azithromycin)的代谢物阿奇霉素德糖胺(descladinose-azithromycin)则均匀进入到肺部中(Figure 5)。该方法能直接可视化抗生素在整个患病的人体器官中的渗透,进一步研究这些对肺部的影响将有助于建立预测模型来解释抗生素失效。
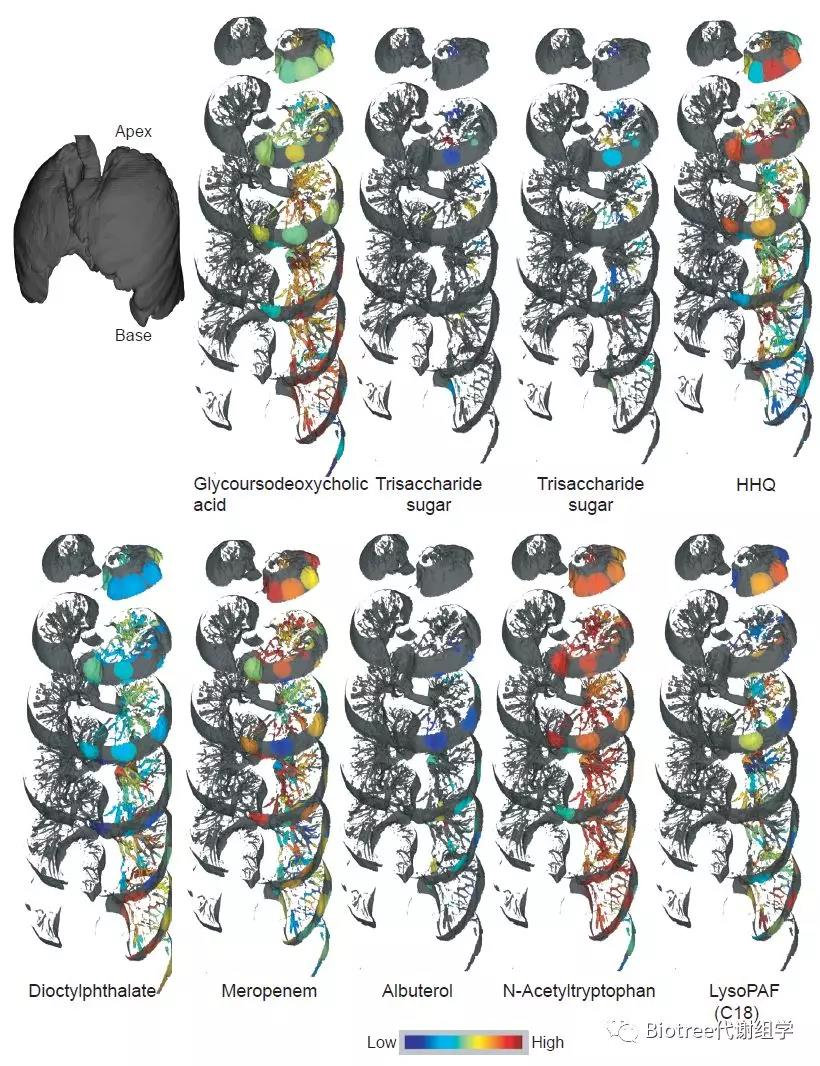
Figure 4. Distributions of Selected Features Identified Using Molecular Networki
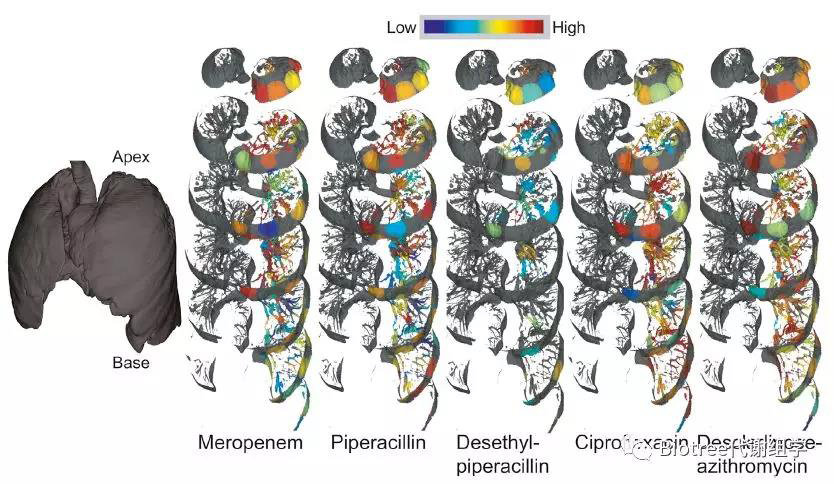
Figure 5. Distributions of Antibiotics and Their Breakdown Products throughout t
微生物组
16s测序结果发现,一些数量较少的微生物,包括无色菌(0%-2.6%)、普氏菌(0%-0.2%)、嗜血杆菌(0%-0.8%)、葡萄球菌(0%-0.02%)、寡养单胞菌(0%-0.4%)也被检测到了(Figure 6),通过微生物分布3D图实现了微生物共定位的可视化。
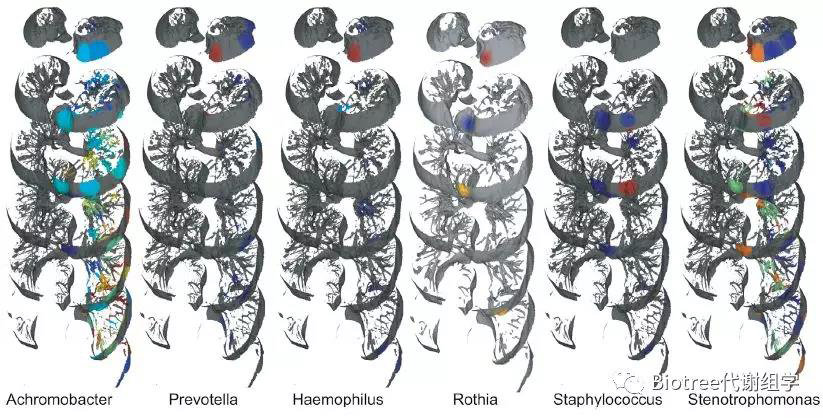
Figure 6. The Distributions of Various Genera
同时,比较了微生物空间分布和分子空间分布的关系,特别是毒性因子和抗生素。发现,喹诺酮类物质或鼠李糖脂类物质的存在与假单胞菌没有很强的相关性,假单胞菌在肺中大量存在并产生这些分子(图7A)。与喹诺酮类和鼠李糖脂类不同,不同抗生素的空间相关性不强,但美罗培南和无色杆菌的分布具有很强的相关性(图7B)。这一结果表明,细菌可以持续存在于肺中抗生素渗透剂量低的区域,从抗生素抗性发展的角度来看,则是一个重要的临床问题。抗生素不会穿透整个肺,这可能会使耐药性的产生变得更容易,然后传播到肺的其他区域。
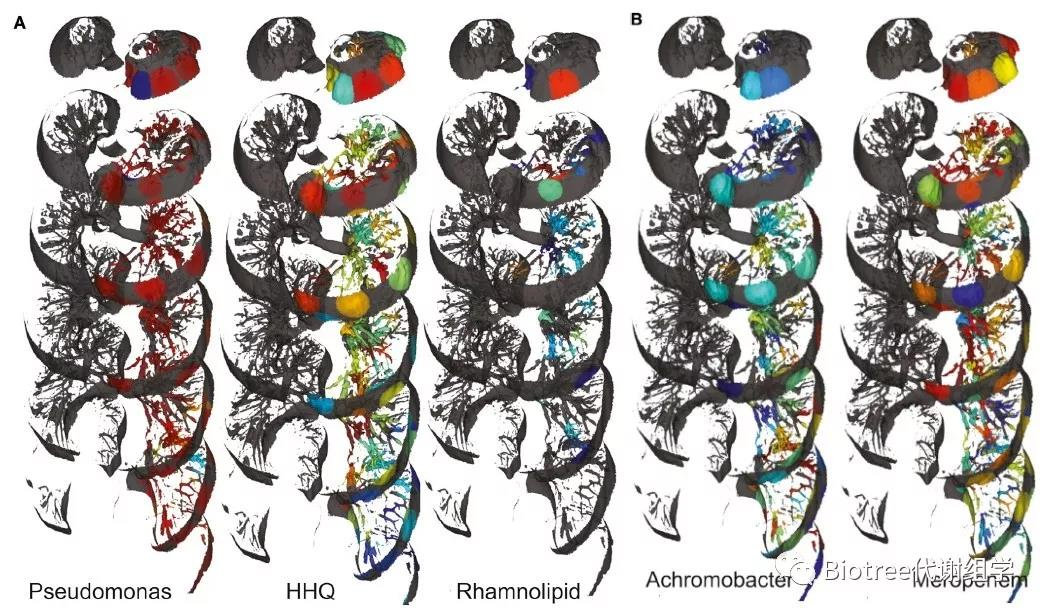
Figure 7. Mapping the Relationships between Microbes and Microbial Molecules and
以上则是小编为大家分享的关于该文章的主要内容,该方法为一个完整器官的代谢组和微生物组提供了全面的视野。此外,本文开发的方法还可以扩展到任何人体器官(特别是具有肿瘤的器官),已知与其自身独特的微生物组相关联并且映射,和关联各种其他类型的组学数据,例如宏基因组和转录组。





 浙公网安备33010802007965号
浙公网安备33010802007965号