糖化血红蛋白(hemoglobin A1c,HbA1c)是糖尿病管理的重要指标。2011年世界卫生组织(World Health Organization, WHO)发布报告,推荐在有条件的地区采用HbA1c诊断糖尿病[1]。HbA1c实验室测定结果准确可比,实现检测的标准化,是HbA1c临床应用的重要前提和保障。经过多年努力,国内外糖化血红蛋白的标准化工作已取得较大进展[2,3,4]。我国目前已建立了完整的HbA1c参考系统,包括国际临床化学与检验医学联合会(International Federation of Clinical Chemistry,IFCC)发布的糖化血红蛋白一级参考测量程序[5,6],国家一级标准物质和数个参考实验室[7]。充分利用参考系统,提高检测质量,是糖化血红蛋白标准化的重要工作内容之一。
方法学评价是研究和评价检测方法性能的常用手段。以往受条件限制,临床实验室多采用已获得临床验证的常规方法或者自选方法作为参比方法,所得数据存在一定的局限性。参考方法是方法学评价首选的参比方法。本研究以IFCC糖化血红蛋白参考方法为参比方法,对临床上常用的4种离子交换高效液相色谱法检测系统和1种毛细管电泳检测系统的正确度进行考察,以及精密度、线性和分析干扰的评价,为参考方法在糖化血红蛋白检测系统的方法学评价研究中的应用提供实例。
材料与方法
一、材料
1.溶血液样本:
收集北京医院检验科和内分泌科、北京协和医院检验科2017年9至10月表观正常体检者及糖尿病患者检测后剩余的乙二胺四乙酸二钾(Dipotassium dihydrogen ethylenediaminetetraacetate,EDTA-2K)抗凝外周血若干,剔除外观明显黄疸、脂血和乳糜等异常样本,置于4 ℃保存。挑选浓度范围均匀分布在22 mmol/mol~147 mmol/mol(4.2%~15.6%,National GlycohemoglobinStandardization Program,美国国家糖化血红蛋白标准化计划,NGSP单位)的样本于48 h内按照IFCC参考方法标准操作程序[5]制成单人溶血液样本40份,分装后-80℃保存,用于正确度考察。本研究样本收集经北京医院伦理委员会批准豁免签署受试者知情同意书(伦理审查批件号2016BJYYEC-121-02)。
2.全血样本:
按上述程序收集北京医院检验科和内分泌科、北京协和医院检验科2018年4至6月表观正常体检者及糖尿病患者剩余EDTA抗凝外周血若干,样本浓度范围为20 mmol/mol~143 mmol/mol(4.0%~15.3%,NGSP单位),置-80 ℃保存。使用前,室温放置30 min充分融化后按照研究方案制成各种混合全血样本用于精密度、线性及分析干扰研究(见下文"方法学评价")。
3.仪器和试剂:
5个糖化血红蛋白检测系统分别为(按中文名称拼音排序):爱科来(Arkray,日本)ADAMS™ HA-8180分析仪及其配套试剂和校准品(试剂批号:8A1321),离子交换高效液相色谱法(简称8180);伯乐(Bio-Rad,美国)Variant™ Ⅱ分析仪及其配套试剂和校准品(试剂批号:64093321/64093322/64139366),离子交换高效液相色谱法(简称VariantⅡ);东曹(TOSOH,日本)HLC-723 G8分析仪及其配套试剂和校准品(试剂批号:K8-201D/8-303C),离子交换高效液相色谱法(简称G8);上海惠中MQ-6000分析仪及其配套试剂和校准品(试剂批号:20180510E),离子交换高效液相色谱法(简称6000);Sebia(法国)Capillarys 2 Flex-Piercing分析仪及其配套试剂和校准品(试剂批号:6067180),毛细管电泳法(简称Capillarys2)。
IFCC参考方法使用的主要分析仪器为液相色谱串联质谱联用系统(liquid chromatography-tandemmass spectrometry,LC-MS/MS),包括高效液相色谱仪Agilent 1200(Agilent,美国)、串联三重四极杆质谱仪API 5000和Analyst 1.4.2数据处理软件(Applied Biosystems,美国)以及配有馏分收集器(型号G1364C)和紫外检测器的高效液相色谱仪Agilent 1200(Agilent,美国)。校准品为IFCC糖化血红蛋白参考实验室网络指定一级参考物质pcal-2014,包括6个水平,浓度范围为0~160mmol/mol。蛋白内切酶(endoproteinase Glu-C)购自罗氏诊断产品有限公司(Roche,瑞士),用去离子水配制为200μg/ml溶液。用于正确度质控的糖化血红蛋白国家一级标准物质GBW09181a、09182a和09183a来自北京医院。
二、IFCC参考方法测定
1.酶切:
取20 μl溶血液样本或30 μl校准品于2 ml样品瓶中,加入50 μl内切酶溶液及420 μl乙酸铵缓冲液(50 mmol/L,pH 4.3),混匀密封后置于37 ℃(±0.5 ℃)温育18~20 h。取出置于-20 ℃及以下停止酶切反应。使用前从冰箱取出,室温放置15 min后进行多肽纯化。
2.多肽纯化:
纯化过程使用的色谱柱为Zorbax XDB C18柱(4.6 mm×150 mm,粒径5 μm,Agilent,美国)。流动相A液为水(含0.05%三氟乙酸),B液为乙腈(含0.05%三氟乙酸),洗脱梯度为B液在5 min内由12%增加至30%,其后在0.1 min内变化至100%并保持1 min。最后在0.1min内返回至12%,在3.8 min后达到平衡。整个梯度洗脱循环总计10 min。每个样本进样25 μl,采集波长为214 nm,使用馏分收集器收集3.9 min至4.5 min的组分,加入等体积的去离子水供LC-MS/MS测定。
3.LC-MS/MS测定:
使用色谱柱为Sunfire® C18柱(2.1 mm×100 mm,3.5 μm,Waters,美国),流动相水(含0.1%甲酸):乙腈(88∶12),流速为0.2 ml/min,进样体积为1 μl。质谱分析采用电喷雾电离源,正离子分析模式,多反应监测扫描方式,监测的离子转变为m/z 348.3→245.1(非糖化β链N-末端六肽)和m/z 429.4→245.1(糖化β链N-末端六肽)。喷雾气、雾化辅助加热气、气帘气和碰撞气均为氮气,分别为60 psi、70 psi、25 psi和6 psi,雾化辅助加热气加热温度为500 ℃。去簇电压、入口电压和喷雾电压分别为30 V、6 V和5 500 V。出口电压和碰撞能量对离子转变m/z 348.3→245.18 V和35V,对m/z 429.4→245.1为11 V和36 V。
4.分析过程:
将校准品和样本随机穿插,以正序和逆序重复测定2次。以两次进样所得数据的均值为测定结果。
5.数据处理:
以校准品糖化六肽和非糖化六肽的峰面积比(rsig)对浓度比(rconc)做回归曲线得到校准方程,由此计算得到待测样本的rconc,按照下式计算糖化血红蛋白水平(Zconc,mmol/mol)。NGSP单位结果由主方程NGSP=0.091 48 IFCC +2.152换算得到。
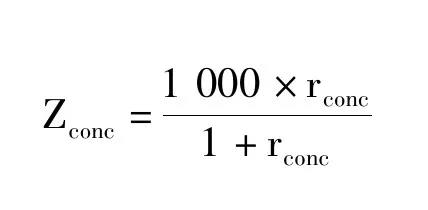
三、方法学评价
1.正确度:
将溶血样本从冰箱中取出,室温放置15 min融化,充分混匀。参照美国临床和实验室标准研究所(Clinical andLaboratory Standards Institute,CLSI)EP9-A3的评价方案,使用5个HbA1c检测系统,以手工模式对40份溶血液样本进行预稀释后测定,稀释剂及稀释比例按照各系统推荐的程序操作。每个样本重复测定3次,将所得数据的均值作为测定结果。用广义极端学生化偏差(extremestudentized deviate,ESD)方法检验离群值点。以IFCC参考方法比对参比方法,绘制偏差图进行初步偏倚评估,使用普通线性回归(ordinarylinear regression,OLR)模型作回归分析。计算两个医学决定水平6.5%(48 mmol/mol,美国糖尿病学会推荐的糖尿病诊断标准)、7.0%(53 mmol/mol,美国糖尿病学会推荐的糖尿病患者控制标准)处的预期偏移。
2.精密度:
按照行业标准《WS/T 492-2016临床检验定量测定项目精密度与正确度性能验证》的评价方案,制备高低两个水平的混合冰冻全血样本,在各系统上以自动稀释模式测定样本。每天分析一批,每个水平同一样品重复测定3次,连续测定5 d,计算实验室内精密度变异系数(coefficient of variance,CV)。
3.线性:
依据CLSI EP6-A文件的评估方案,选取低值(20 mmol/mol,4.0 %HbA1c)和高值(144 mmol/mol,15.3%HbA1c)全血样本各1份,按照一定比例将两者稀释混合,得到7个不同浓度的样本,在各系统上以手工模式稀释样本后进行测定,每个浓度水平测定2次,将所得数据的均值作为测定结果。以理论糖化血红蛋白浓度(根据高值、低值样本的糖化血红蛋白浓度和稀释比例分别计算)为自变量,测定结果为因变量进行多项式线性评价。
4.分析干扰:
依据CLSI EP7-A2文件的方案,制备HbA1c浓度约为31 mmol/mol和69 mmol/mol(5%和8.5%)EDTA-全血2份作为基础样本,分别加入下述干扰物质,每种干扰物质添加5种不同浓度,包括结合溶血血红蛋白(1 000 mg/dl~5 000 mg/dl)、乳糜(100 FTU~1 400 FTU)、胆红素(1 mg/dl~18 mg/dl)、阿司匹林(10 mg/L~160 mg/L)和维生素C(2.5 mg/dl~50 mg/dl)。另制备添加不同浓度葡萄糖(5 mmol/L~250 mmol/L)的样本,于37 ℃水浴孵育3 h后取出置于-20 ℃保存备用。在5个系统上以手工模式稀释样本后进行测定各个干扰样本,每种每个浓度水平测定2次,将所得数据的均值作为测定结果。
5.统计学分析:
用Microsoft Excel 2010软件对正确度、精密度、线性和分析干扰的实验结果进行统计。
结果
一、IFCC参考方法测定结果
40个溶血液样本分为4批测定,每批20个样本,每个样本重复测定两批。每批测定同时测定国家一级标准物质GBW 09181a、09182a或09183a作为正确度质控。40个样本重复测定的平均CV为1.4%(范围0.2%~2.5%)。4个批次正确度质控品与靶值的相对偏倚为-1.6%~ 0.13%,均包含在所用标准物质的扩展相对不确定度(k=2)范围内。
二、方法学评价结果
1.正确度:
对5个HbA1c系统40份溶血液样本的测定结果用ESD方法检验,未发现离群值。8180、VariantⅡ、G8、6000和Capillarys 2的最大偏移(ESD1)依次分别为2.57、3.04、2.47、2.78和2.41,临界值





 浙公网安备33010802007965号
浙公网安备33010802007965号