【1】PNAS:重大进展!发现胎盘干细胞能够再生心脏,有望开发出新型干细胞疗法来治疗心脏病
DOI:10.1073/pnas.1811827116.
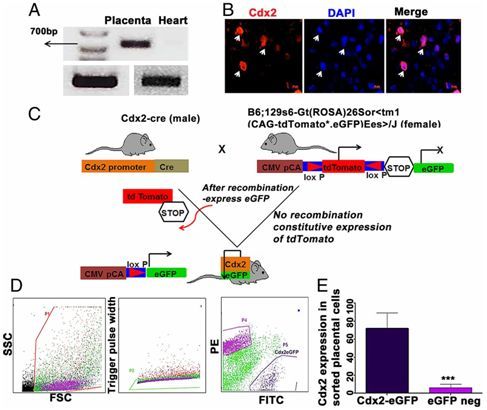
在一项新的研究中,来自美国西奈山伊坎医学院的研究人员证实在动物模型中,来自胎盘的称为Cdx2细胞的干细胞能够在心脏病发作后再生健康的心脏细胞。这些研究结果可能代表了一种再生心脏和其他器官的新疗法。相关研究结果发表在PNAS期刊上。
图片来源:PNAS
这些研究人员之前曾发现一种混合的小鼠胎盘干细胞群体能够有助于怀孕雌性小鼠的心脏在遭受有可能导致心力衰竭的损伤后恢复。他们发现了这些胎盘干细胞迁移到怀孕雌性小鼠的心脏中,而且是直接迁移到心脏受损部位中。它们随后经过自我重编程变成跳动的心脏细胞,从而有助这种修复过程。这项新研究旨在确定哪种类型的干细胞能够让心脏细胞再生。这些研究人员首先研究了Cdx2细胞,这是之前鉴定出这种混合的干细胞群体中最为常见的干细胞类型,结果发现它们占来自胎盘的有助于心脏再生的干细胞比例最高(40%)。
为了测试Cdx2细胞的再生特性,这些研究人员在三组雄性小鼠中诱发了心脏病发作。第一组接受来自终末妊娠小鼠胎盘的Cdx2干细胞处理,第二组接受不表达Cdx2的胎盘细胞处理,第三组作为对照接受盐水处理。他们使用磁共振成像技术在诱导心脏病发作后立即分析所有小鼠,并且在诱发心脏病发作后接受细胞或生理盐水处理3个月后再次分析这些小鼠。他们发现,Cdx2干细胞处理组中的每只小鼠在心脏健康组织方面都有明显的改善和再生。到三个月时,这些干细胞直接迁移到心脏受损部位,并且形成新的血管和新的心肌细胞(跳动的心肌细胞)。注射生理盐水和非Cdx2胎盘细胞的小鼠发生心力衰竭,而且它们的心脏并未出现再生的证据。
这些研究人员注意到Cdx2细胞的另外两个特性:它们除了具有胚胎干细胞的所有蛋白,还具有其他的蛋白,这使得它们能够直接迁移到损伤部位,这是胚胎干细胞无法做到的事情,而且它们似乎避免了宿主免疫反应。当将来自胎盘的Cdx2细胞注射到另一只动物中时,宿主免疫系统并不排斥它们。
【2】Sci Rep: 抑制蛋白质磷酸化制促进损伤后的视神经再生
DOI: 10.1038/s41598-019-43658-w
早稻田大学Toshio Ohshima教授的一项新研究发现,抑制塌陷反应介质蛋白2(CRMP2)(一种微管结合蛋白)的磷酸化可以抑制神经纤维的退化,促进视神经损伤后的再生。最近在《Scientific Reports》杂志上发表的这项研究结果可以为视神经病变患者开发新型治疗方法。
在过去的研究中,已经发现了抑制轴突再生的潜在机制,并且认为解决这些机制可以使科学家们在开发新的中枢神经系统损伤治疗方法方面更进一步。CRMP2蛋白质分子起到稳定微管的作用,微管在神经元细胞水平为中枢神经系统提供结构支持,并通过与微管蛋白二聚体结合促进聚合。然而,这些功能通过磷酸化(一种调节神经元蛋白的机制)被各种激酶阻止。
"在我们之前的研究中,我们所做的是开发CRMP2敲入小鼠并从基因上抑制其CRMP2磷酸化,"Ohshima教授解释说。 "结果,CRMP2敲入小鼠在脊髓损伤后表现出轴突再生的促进。由此,我们假设在视神经损伤后也可以观察到相同的现象。"在该研究中,科学家们比较了视神经挤压引起的视神经损伤后野生型和CRMP2过表达小鼠视神经的变性和再生情况。他们发现视神经挤压伤后微管的去稳定和解聚在CRMP2过表达小鼠中被抑制,并且视网膜神经节细胞的损伤也减少了。
此外,在视神经挤压后4周,CRMP2过表达小鼠视神经中GAP43(一种轴突再生的分子标记)的蛋白水平高于野生型小鼠。另外,在CRMP2过表达小鼠中视神经挤压后,视神经中的轴突数量增加。
【3】Science:发现有助于蝌蚪尾巴再生的新型细胞类型
DOI:10.1126/science.aav9996.
在一项新的研究中,来自英国剑桥大学等研究机构的研究人员发现一种特殊的皮肤细胞群体可协调青蛙的尾部再生。这些再生指导细胞(regeneration-organizing cell, ROC)有助于解释自然界的一个重大谜团,并可能提供关于如何在哺乳动物组织中实现这种能力的线索。相关研究结果发表在Science期刊上。
通过使用单细胞基因组学技术,这些研究人员开发出一种巧妙的策略来揭示不同蝌蚪细胞在再生它们的尾巴时会发生什么。具体而言,他们详细地分析了非洲爪蟾(Xenopus laevis)蝌蚪受损后参与再生的细胞类型。Hiscock博士说:"蝌蚪可以在其一生中再生它们的尾巴;但是在发育的一个精确阶段的两天内,它们失去了这种能力。我们利用这种自然现象来比较蝌蚪中存在的能够再生的细胞类型和那些不在能够再生的细胞类型。"
这些研究人员发现干细胞的再生反应是由表皮(皮肤)细胞的一个亚群协调的,他们称之为ROC细胞。Aztekin说,"这是一个令人吃惊的过程,值得进一步观察。在尾巴截肢后,ROC从身体向伤口迁移并分泌一系列生长因子来协调组织前体细胞的反应。这些细胞随后一起再生出具有正确尺寸、图案和细胞组成的尾巴。"在哺乳动物中,诸如皮肤表皮、肠上皮和血液系统之类的许多组织在一生当中经历不断的更替。因衰竭或损伤而丢失的细胞由干细胞补充。然而,这些特定的细胞通常致力于产生组织中的细胞亚谱系,而且除了肝脏和皮肤等少数组织之外,所有器官和组织再生的能力都已丧失。
【4】Gene Dev:"白马王子亲吻"能够促进大脑再生?
DOI: 10.1101/gad.323196.118
京都大学研究小鼠脑化学的研究人员揭示了基因表达的潮起潮落,可能会唤醒神经干细胞的沉睡。这些发现也可能适用于身体其他部位的干细胞,最近发表在《Genes&Development》杂志上。
京都大学边境生命与医学科学研究所的组长Ryoichiro Kageyama说:"我们之前没有人直接将胚胎中的活性干细胞与无活性的"静止"成体干细胞进行比较,他们指出至少有两个基因及其已经鉴定了调节激活的相关蛋白质。该团队将注意力集中在蛋白质'Hes1'上,后者在成体细胞中强烈表达。这通常会抑制其他蛋白质如'Ascl1'的产生,其中少量的蛋白质由活性干细胞周期性地产生。随着时间的推移监测两种蛋白质的产生,该团队确定了一种类似波浪的模式,导致干细胞苏醒并转变为大脑中的神经元。当他们"敲除"制造Hes1所需的遗传密码时,细胞开始产生更多的Ascl1,然后几乎激活了所有的神经干细胞。
"重要的是,相同的基因对这些干细胞的活跃和静止状态负责,"Kageyama补充说。 "只有两者之间的表达动态不同。更好地理解这些不同表达动力学的调节机制可以让我们将休眠细胞转换为治疗一系列神经系统疾病的一部分。"
【5】Nature重磅:基因疗法促进心脏再生
DOI: 10.1038/s41586-019-1191-6
来自伦敦国王学院的研究人员发现,一种疗法可以诱导心脏病发作后的心脏细胞再生。在近日发表在《Nature》杂志上的这项研究中,研究团队将一小段名为microRNA-199的基因材料植入猪的心脏。这段基因可以在猪发生心肌梗死一个月后,促进其心功能几乎完全恢复。
研究报告的主要撰写者、伦敦国王学院的Mauro Giacca教授说:"这对这一领域来说是一个非常激动人心的时刻。在用干细胞再生心脏的多次尝试都失败之后,我们第一次在大型动物身上看到了真正的心脏修复。"这是第一次证明心脏再生可以通过使用一种有效的基因药物来实现,这种药物可以刺激大型动物的心脏再生,就像人类的心脏解剖和生理一样。
"我们还需要一段时间才能进行临床试验,"Giacca教授解释说。"我们仍然需要学习如何将RNA作为一种合成分子应用于大型动物,然后应用于患者,但我们已经知道,这在老鼠身上效果很好。"
【6】Genes & Devel:科学家成功"唤醒"沉睡中的神经干细胞 解锁大脑的再生潜能
DOI:10.1101/gad.323196.118
近日,一项刊登在国际杂志Genes & Development上的研究报告中,来自日本京都大学的科学家们通过对小鼠的大脑化学机制进行研究发现,基因表达的起起伏伏或会让神经干细胞从睡梦中醒来,相关研究结果有望帮助科学家们理解大脑再生的潜力,并开发治疗多种神经性疾病的新型疗法。
研究者Ryoichiro Kageyama说道,在我们之前并没有科学家们能直接将胚胎中的活性干细胞与失活的休眠成体干细胞进行对比,深入研究后,研究人员重点关注了一种在成体细胞中强烈表达的名为Hes1的蛋白质,正常情况下,其会抑制名为Ascl1蛋白质的产生,其中一小部分是由活性干细胞周期性产生的。随着时间延续监测这两种蛋白质的产生,研究人员就发现了一种波形模式,其能促进干细胞苏醒并转化成为大脑中的神经元细胞。
当研究者敲除了制造Hes1所需要的遗传代码后他们发现,细胞就开始制造更多的Ascl1蛋白质,随后其就会激活几乎所有的神经干细胞,研究者Kageyama表示,最关键在于相同的基因同时负责这些干细胞的活性和静息状态,只有表达的动力学才会在其二者之间有所不同,更好地理解不同表达动态模式下的调节性机制或能帮助研究者开启休眠的干细胞,并利用其来治疗一系列神经变性疾病。
【7】Nature:重磅!鉴定出一种独特的肠道干细胞可再生受损肠道
DOI:10.1038/s41586-019-1154-y
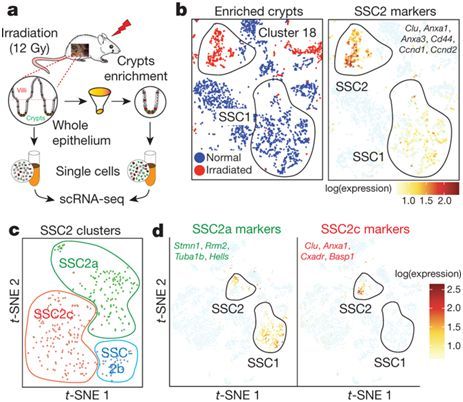
在一项新的研究中,来自加拿大西奈山医院、多伦多大学和麦吉尔大学健康中心研究所的研究人员利用单细胞RNA测序分析了再生的小鼠肠道,并鉴定出一种独特的可被损伤激活的静止细胞类型,他们称之为复活干细胞(revival stem cell, revSC)。相关研究结果发表在Nature期刊上。
图片来源:Nature
revSC以凝聚素(clusterin)高表达为特征,在稳态条件下是非常少见的,但可按照时间层次产生所有主要的肠道细胞类型,包括LGR5+ CBC。
在通过辐射、靶向剔除LGR5+ CBC或右旋糖酐硫酸酯钠处理导致肠道受损后,revSC经历一种YAP1依赖性的短暂增殖,重建LGR5+ CBC区室并且是再生功能性肠道所必需的。
综上所述,这些研究结果确定了一类独特的干细胞,它们可因肠道损伤而被调动,从而恢复静态的干细胞区室,并且再生肠上皮。
【8】Sci Transl Med:华人学者开发纳米纤维-水凝胶复合材料促进软组织再生
DOI: 10.1126/scitranslmed.aau6210
约翰霍普金斯大学医学院的一组研究人员已经开发出一种凝胶,这种凝胶注射到实验动物体内时,可以让新的软组织生长从而取代失去的组织。在这项发表于《Science Translational Medicine》杂志上的论文中,该小组描述了他们开发这种凝胶的过程,以及它在实验大鼠和兔子身上的效果。在这项新的研究中,研究人员开发了一种新的凝胶,有望成为软组织再生工具。
为了制作这种凝胶,研究小组使用一种已知的易于生物降解的聚合物来制造纳米纤维,这种材料已经在实际的医疗应用中使用了好几年。接下来,研究人员对纳米纤维进行了处理,使其中一些纤维能够与透明质酸结合--在实际的医疗应用中医生也在使用透明质酸--在这种情况下,纳米纤维可以形成凝胶,促进巨噬细胞的渗透,从而导致人体生成血管。研究人员因此获得了一种容易注射的凝胶,可以作为支架,也可以促进失去的软组织再生。
研究人员注意到这种凝胶的触感非常接近真实组织,既有弹性又有柔软性。研究人员在实验鼠和兔子身上测试了他们的凝胶,研究人员从实验鼠和兔子身上取出组织,然后用凝胶填充空洞。据他们报告,凝胶在凝固前很容易与空腔的形状相吻合。但更重要的是,巨噬细胞会出现并开始渗透到凝胶中,发出信号诱导身体在凝胶中产生新的细胞和血管。最终的结果是失去的组织可以再生。
研究人员指出,这种凝胶可以帮助再生10立方厘米以下的缺失的软组织,这些组织的大小和人类手指差不多。研究人员预计很快就会在人类身上进行临床试验测试这种新凝胶,因为所有的成分都已经用于其他医疗应用。
【9】Cell:揭示体细胞突变促进肝脏组织再生
DOI:10.1016/j.cell.2019.03.026
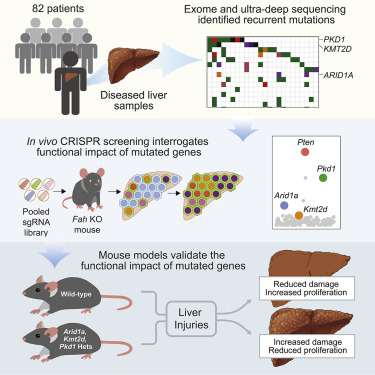
在一项新的研究中,来自美国国家糖尿病、消化与肾疾病研究所和德克萨斯大学西南医学中心的研究人员通过对来自82名患者的患病肝脏样本进行外显子组测序,揭示出肝硬化中的复杂突变景观。相关研究结果发表在Cell期刊上。
图片来源:Cell
进一步的超深度测序鉴定出PKD1、PPARGC1B、KMT2D和ARID1A基因发生频发突变(recurrent mutation)。细胞突变体克隆的数量和大小随着肝脏纤维化阶段和组织损伤的增加而增加。
为了研究突变基因的功能影响,这些研究人员建立了一种合并的体内CRISPR筛选方法。与测序结果一致的是,对147个基因的检测再次表明Pkd1、Kmt2d和Arid1a的缺失促进了克隆扩增。在小鼠中,这些基因的条件性杂合缺失在组织损伤检测中也具有保肝作用。癌变前的体细胞突变通常从癌症的视角来观察,但是他们证实突变能够促进肝脏组织再生,而可能与癌症发生无关。
【10】Nat Biotechnol:可注射的海绵状凝胶促进T细胞再生
DOI:10.1038/s41587-019-0017-2.
在一项新的研究中,来自美国哈佛大学的研究人员开发出一种可注射的海绵状凝胶,可增强骨髓移植后的T细胞产生,从而增加了免疫系统中的这些关键组分的数量和多样性。这种生物工程支架(即海绵状凝胶)可在骨髓移植的同时注射到皮肤下,从而有助于在接受移植后恢复免疫系统。相关研究结果发表在Nature Biotechnology期刊上。

图片来源:Harvard University
利用Mooney实验室在用于提供细胞指导性线索的生物材料开发方面的开拓性研究成果,这些研究人员设计了一种具有允许细胞进出的大孔的海绵状凝胶。这种凝胶具有两种内置的蛋白:第一种蛋白招募外部细胞,第二种蛋白促进T细胞祖细胞(T-cell progenitor)产生。第一种蛋白称为骨形态发生蛋白2(BMP2),招募局部的细胞并促进它们变成骨细胞。一旦这种凝胶类似于血管化的骨髓,第二种蛋白就促进生活在这种生物工程支架中的造血干细胞产生T细胞祖细胞。
当这些研究人员在接受造血干细胞移植的小鼠中测试这种生物工程支架时,他们发现相比于没有接受这种支架注射的小鼠,接受这种注射的小鼠更快地产生T细胞。这些研究人员还发现,在植入这种生物工程支架的小鼠中,移植物抗宿主病的发生率显着降低,其中在移植物抗宿主病中,供者细胞攻击患者的健康组织和器官。接下来,这些研究人员的目标是扩大这项研究的规模,使得它适用于临床环境。
转载于生物谷Bioon.com





 浙公网安备33010802007965号
浙公网安备33010802007965号