发表期刊:Cell Metabolism
影响因子:22.415
发表时间:2018年
合作单位:中国科学院广州生物医药与健康研究院
今天BIOTREE技术支持部的小伙伴Hannah将给大家分享阿趣生物协助客户发表在Cell Metabolism上的一篇文章:Short-Term Mitochondrial Permeability Transition Pore Opening Modulates Histone Lysine Methylation at the Early Phase of Somatic Cell Reprogramming。
什么是“线粒体闪烁”?横跨线粒体内外膜的线粒体通透性转换孔(mPTP)的瞬时开放称为“线粒体闪烁”[1]。mPTP在细胞的生存和凋亡中起到了决定性的意义。孔完全开放会导致细胞的凋亡,孔的瞬时开放会调控细胞的发育。
线粒体在多能干细胞(一种具有自我更新,自我复制能力的多潜能细胞)的发育中起到重要作用,而体细胞再编程到诱导多功能干细胞重构染色质的修饰,这一过程是否以及如何通过线粒体中的信号进行调节还不得而知。
那么什么又是体细胞重编程呢?对一个分化成熟的细胞来说,其细胞核全能性的实现是建立在与卵细胞质融合基础上的。这种由体细胞向全能细胞的转变称为体细胞重编程[2]。大家熟知的克隆羊多莉就是这么“问世”的。
但现在要实现这一目的,体细胞核移植并不是唯一手段。2006年日本科学家山中伸弥(Shinya Yamanaka)首次利用病毒载体将四个转录因子的组合转入分化的体细胞中,使其重编程而得到了类似胚胎干细胞的一种细胞类型——诱导多能干细胞(iPSCs)。该成果在2012年被授予了诺贝尔生理学/医学奖。
mPTP的开放及关闭对细胞的凋亡及发育产生的影响这背后是否以及是如何调控细胞核的还是未知的。基于以上结果,学者将研究的重心转移至mPTP。研究发现在重编程的早期mPTP经历了短期开放,这种短暂的激活增强了重编程。短期mPTP的打开触发线粒体ROS/miR-101c通路,增强PHF8(结构同源植物域指蛋白)介导的多能性基因的H3K9me2/H3K27me3去甲基化,降低其在多能基因启动子区的占有率,提高重编程效率。
在重新编程的早期阶段mPTP的短期开放
为了确定mPTP在重编程过程中的状态,对小鼠胚胎成纤维细胞(MEFs)在Sox2、Klf4、Oct4、c-Myc (SKOM)介导的重编程过程中的mPTP进行了监测。研究发现mPTP的开放度在第3天增加,在第5天再次下降,并在第8天保持这个水平,钙黄绿素荧光染剂(Calcein)与mPTP开放程度呈负相关(图A, B)。
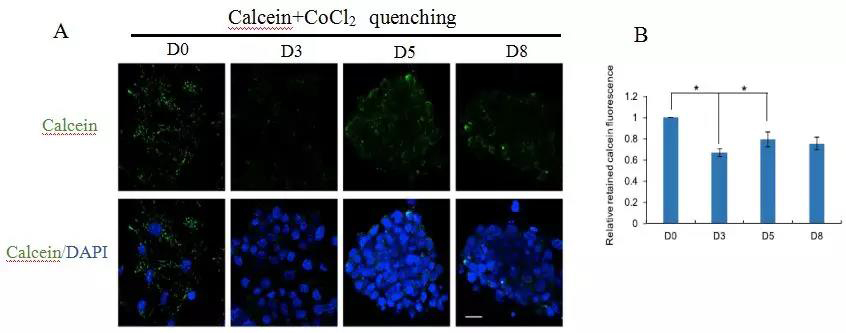
注:A: 共聚焦图像在重新编程的第0、3、5和8天分析mPTP的开放情况。样品与calcein和CoCl2共载。B: 细胞相对残留钙黄绿素荧光在重编程过程中分别于第0、3、5、8天的定量情况。
早期的mPTP开放增强了重新编程
为了确定mPTP在重编程中起到的作用,研究人员区分了包含转基因 Oct4 促进因素驱动绿色荧光蛋白(GFP)表达在内的MEFs (小鼠胚胎成纤维细胞),根据钙黄绿素荧光的强度确定mPTP的放开。图中可以看出高mPTP开放细胞的重编程效率高于低mPTP开放的效率(图C)。
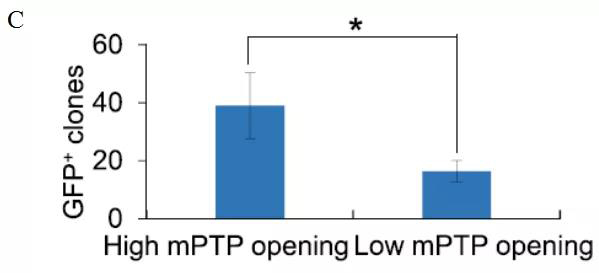
注:对高、低mPTP开放度的skom感染细胞进行排序后,定量分析重组效率。
为了进一步研究mPTP在重编程中的作用,研究人员通过增加或减少功能的方法来调节mPTP的打开。他们发现关键的mPTP组分亲环素D(CypD)的过度表达导致mPTP打开,而CypD沉默抑制mPTP打开,这是一种线粒体基质肽基脯氨酰顺反式异构酶,目前已知的可调节mPTP的开放(图D)。
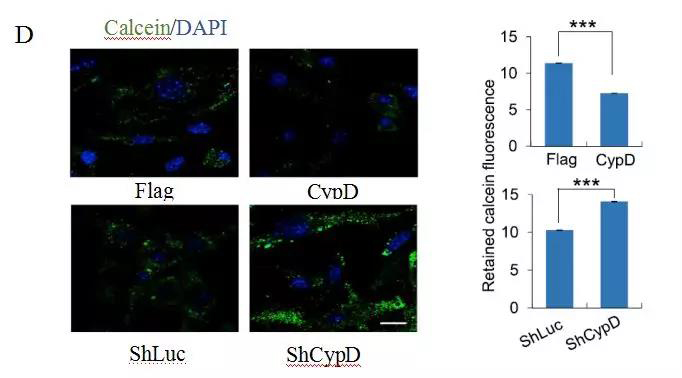
注:D: 在CypD过表达或沉默的条件下,用shRNA分析mPTP的开放情况。左图为典型的共焦图
CypD过表达H3K9me2和H3K27me3的去甲基化依赖于PHF8
检测了有或没有CypD过表达的细胞重编程第3天组蛋白的甲基化状态。实验发现,与对照组相比,在CypD过表达重编程的第3天和第4天,H3K9me2和H3K27me3的水平下降(图E),而其他测试组没有显示明显的变化。通过H3K9me2和H3K27me3染色质免疫沉淀(ChIP)实验分析其占用率,发现CypD过表达降低了其在Sox2、Nanog、Oct4等多能基因启动子区域的占用率。因此,mPTP的激活导致H3K9me2和H3K27me3的整体去甲基化。H3K9和H3K27的甲基化受多种组蛋白去甲基化酶的调控,为了找出哪些组蛋白去甲基化酶参与了mPTP的开放。我们检测了不同组蛋白去甲基化酶在有或无CypD过表达的细胞SKOM重编程过程中的表达水平。结果表明,在被检测的蛋白中,只有PHF8在CypD过表达时增加(图F)。此外,研究人员在重编程中使用shRNA对PHF8进行沉默,发现敲除PHF8可以恢复H3K9me2和H3K27me3的水平,并通过CypD过表达削弱重编程效率的提高(图G)。
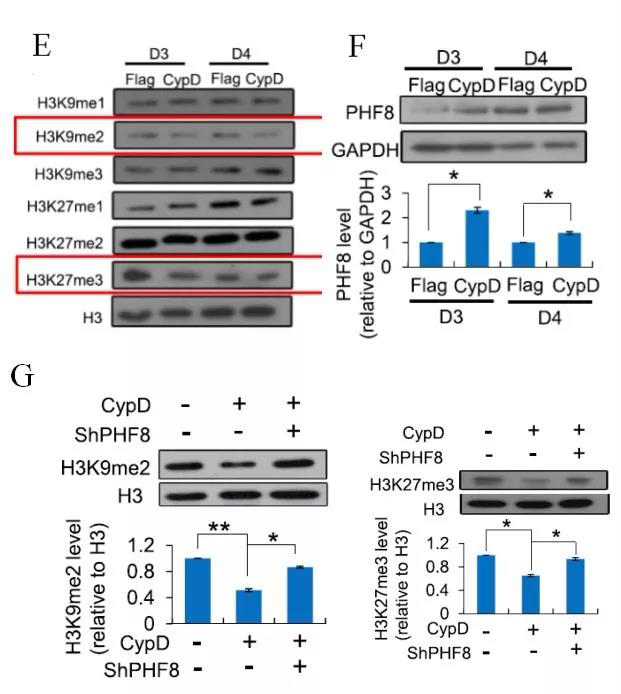
注:E: 重组过程中CypD过表达第3天和第4天后H3K9me1/2/3和H3K27me1/2/3的Western blot分析。F: 重组后第3天和第4天CypD过表达细胞中PHF8的Western blot分析。G: H3K9me2和H3K27me3经PHF8 shRNA处理和不经PHF8 shRNA处理的CypD过表达细胞在重编程后第3天的Western blot分析。
靶标代谢组学对α-KG进行定量分析
PHF8催化赖氨酸去甲基化,需要a-酮戊二酸(a- KG),这是三羧酸循环的中间代谢产物,采用超高效液相色谱串联质谱法(UHPLC-MS/MS)进行定量测定代谢物水平,研究人员通过代谢物分析来定量重编程中CypD过表达后的a-KG水平。CypD过表达细胞的a-KG水平高于对照组(图H)。因此,a- KG的增加可能是PHF8活性增加的一个因素。
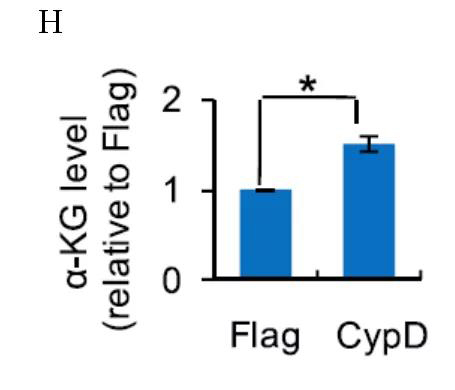
注:重组后第3天Flag和CypD过表达细胞中a-KG水平的高效液相色谱-质谱分析
结语
本实验发现线粒体通透性转换孔(mPTP)在重编程的早期经历了短期开放,mPTP的开放使H3K9me2和H3K27me3发生去甲基化,导致它们在细胞中的多能性基因的启动子区域占有率降低。mPTP的开放增加了线粒体活性氧产物下游的PHF8蛋白水平和mir-101c,同时也提高了PHF8的辅因子a-酮戊二酸的水平。从而促进体细胞转变为多能干细胞。研究结果表明,在mPTP介导的表观遗传调控下,线粒体到核的新途径决定了细胞的命运。同时进一步拉近了干细胞和临床疾病治疗的距离。而该方法与经典的胚胎干细胞和体细胞核移植技术不同的是,它不使用胚胎细胞或卵细胞,所以没有伦理学问题。虽然该方法的安全性还有待考量,但在发病机理以及疾病诊断等医学方面都有巨大的潜力,值得未来深入地研究及学习。
参考文献
[1]Ying Z , Chen K , Zheng L , et al. Transient Activation of Mitoflashes Modulates Nanog at the Early Phase of Somatic Cell Reprogramming[J]. Cell Metabolism, 2015, 23(1).
[2]安威.医学细胞生物学(第三版):北京大学医学出版社,2013
原创: Hannah Biotree代谢组学





 浙公网安备33010802007965号
浙公网安备33010802007965号