抗生素和饮食习惯会影响肠道微生物群落,从而使人类易患代谢综合征等多种疾病。尽管微生物群对产后环境的影响已得到充分证明,但关于肠道菌群对胚胎期的影响还知之甚少。近期,发表在国际期刊Science上题目为《Maternal gut microbiota in pregnancy influences offspring metabolic phenotype in mice》的文章,探讨了小鼠母体肠道菌群对后代胚胎发育和生命后期疾病易感性的影响,结果发现孕期母体肠道菌群通过产生短链脂肪酸,塑造胚胎的代谢系统发育。下面来看看具体研究内容吧。

作者首先在无病原体(SPF)和无菌(GF)条件下饲养了孕期母鼠,待小鼠出生后由养母在常规条件下饲养,以适应出生后的生长环境。断奶后,小鼠被喂食高脂肪饮食(HFD)以诱发肥胖。结果发现尽管来自GF-ICR孕鼠的后代出生后体重小于来自SPF-ICR孕鼠的后代,但在生长过程中,其后代因食用HFD而发生显著肥胖。与SPF孕鼠的子代相比,GF子代肾周或皮下白色脂肪组织(WAT)和肝脏的重量显著增加,同时,GF子代的血糖、TGs、非酯化脂肪酸(NEFAs)和总胆固醇水平显著升高,体温和心率显著降低。此外,GF子代表现出食物摄入增加,血浆中肠激素肽YY(PYY)和胰高血糖素样肽-1(GLP-1)水平降低,能量消耗减少以及HFD诱导的葡萄糖耐受不良和胰岛素抵抗显著加速的情况。这些结果表明,在HFD喂养下,GF后代表现出肥胖表型。文中还发现成年期的肠道微生物群不是GF后代肥胖倾向表型的主要因素,而且GF子代的代谢紊乱是普遍存在的,与品系和性别无关(图1)。
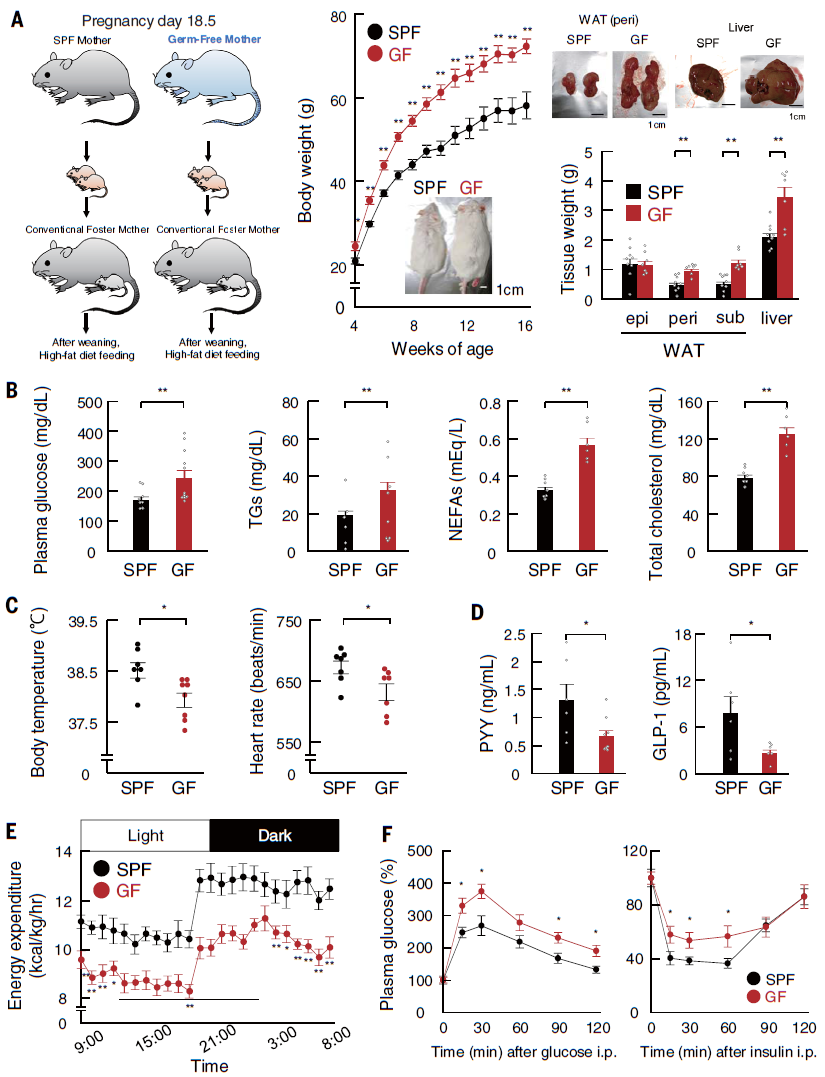
图1 喂食HFD后,GF孕鼠的后代表现出严重的肥胖表型
考虑到微生物组成的变化可能会导致生态失调,从而导致宿主中的易感疾病表型。而肠道微生物群衍生代谢物如短链脂肪酸等,不仅为宿主细胞提供燃料,还充当肠道微生物群和肠外器官之间的信号分子。于是作者假设来自母体肠道微生物群的代谢物信号可能会转移到胎儿体内并影响代谢系统的发育。因此分析了SPF和GF-ICR孕鼠及其胚胎中亲水和亲脂代谢产物的血浆水平。结果发现只有5种代谢物在孕鼠和胚胎中表现出与饲养条件相似的变化。尤其是GF孕鼠和胚胎的血浆SCFAs(乙酸、丙酸和丁酸)水平明显低于SPF对应者。考虑到妊娠期间SPF组的孕鼠和胚胎的血浆SCFAs水平是恒定的,母体肠道微生物群似乎通过血流向胚胎构成供应SCFAs。同时作者在胚胎和成年期的交感神经节中检测到Gpr41 mRNA的双相表达,结肠中Gpr43表达的双相增加,胰腺中Gpr43 mRNA水平在围产期-产后期间短暂升高。这些结果表明胚胎代谢组织,如交感神经系统、肠道和胰腺,可能通过表达GPR41和GPR43来感知母体肠道微生物衍生的SCFAs(图2)。
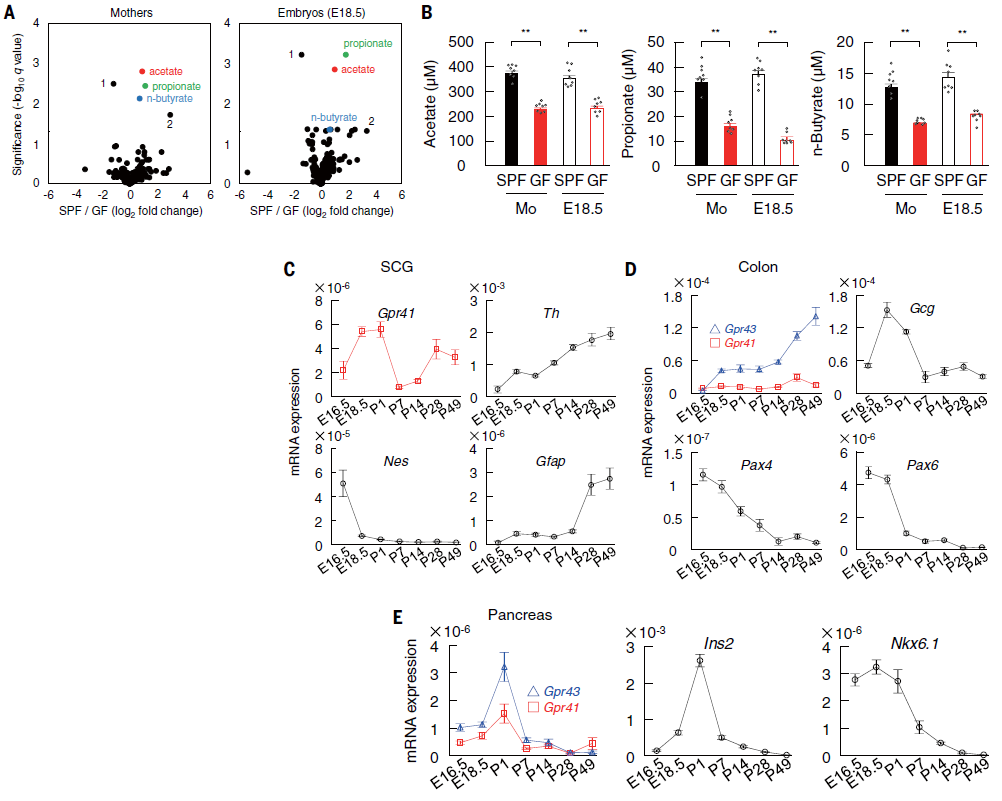
图2 胚胎SCFAs依赖于母体肠道微生物群,受体已经在胚胎期表达
接着,作者进一步研究了在胚胎发育过程中GPR41在交感神经系统中的作用以及GPR43在肠和胰腺中的作用。由于GPR41最有效的激动剂是丙酸盐,而且丙酸盐是一种比乙酸盐或丁酸盐更有效的GPR43配体,文中重点研究了丙酸盐介导的GPR41和GPR43信号转导作用。结果发现,与野生型(WT)胚胎相比,Gpr41−/−C57BL/6J胚胎和具有相同背景的GF胚胎到心脏的交感神经投射明显减少。丙酸诱导的Gpr41−/−胚胎交感神经细胞分化被阻断。用抗生素治疗WT孕鼠,发现幼鼠的交感神经对心脏的投射明显减弱,但在孕期补充丙酸后得到改善(图3)。同时发现丙酸显著促进WT胚胎肠类器官中GLP-1+肠内分泌细胞的分化,这种效应在Gpr43−/−胚胎的类器官中被消除。丙酸盐和合成的GPR43激动剂苯乙酰胺-1(PA-1)促进了向胰岛素+β细胞的分化;然而,这种作用受到RNA干扰介导的GPR43基因敲除的影响(图4)。因此,作者推断来自母体肠道微生物群的丙酸盐通过GPR41促进交感神经的发育,通过激活GPR43促进胰腺β细胞和GLP-1阳性肠内分泌细胞的分化。
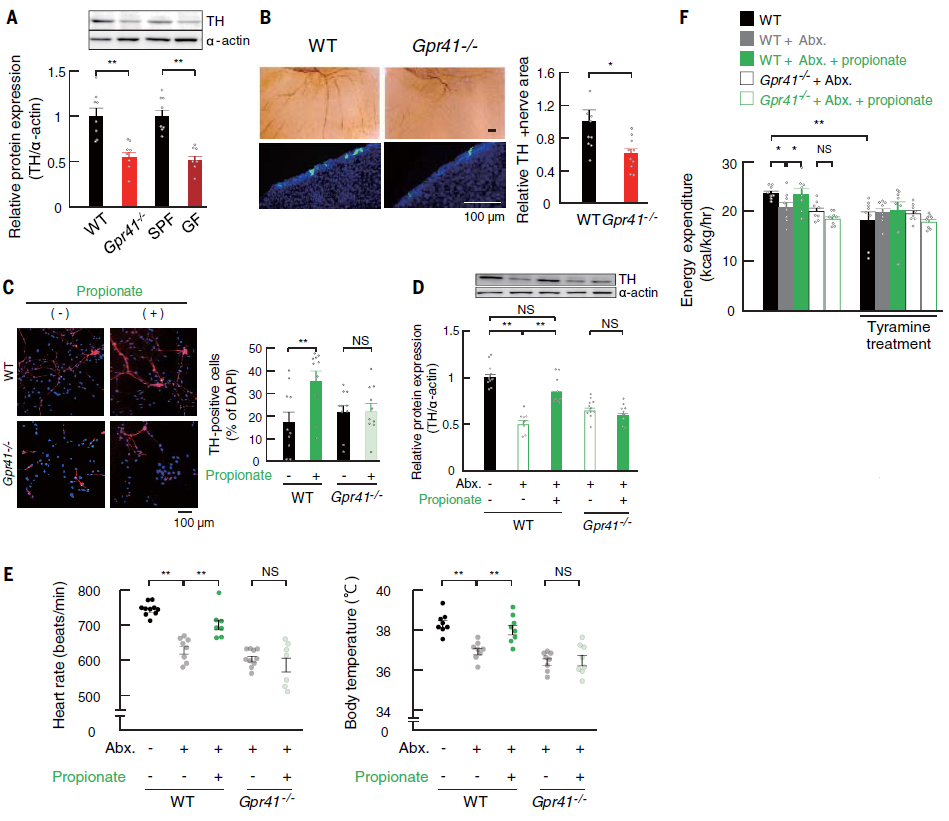
图3 丙酸通过胚胎GPR41促进交感神经分化
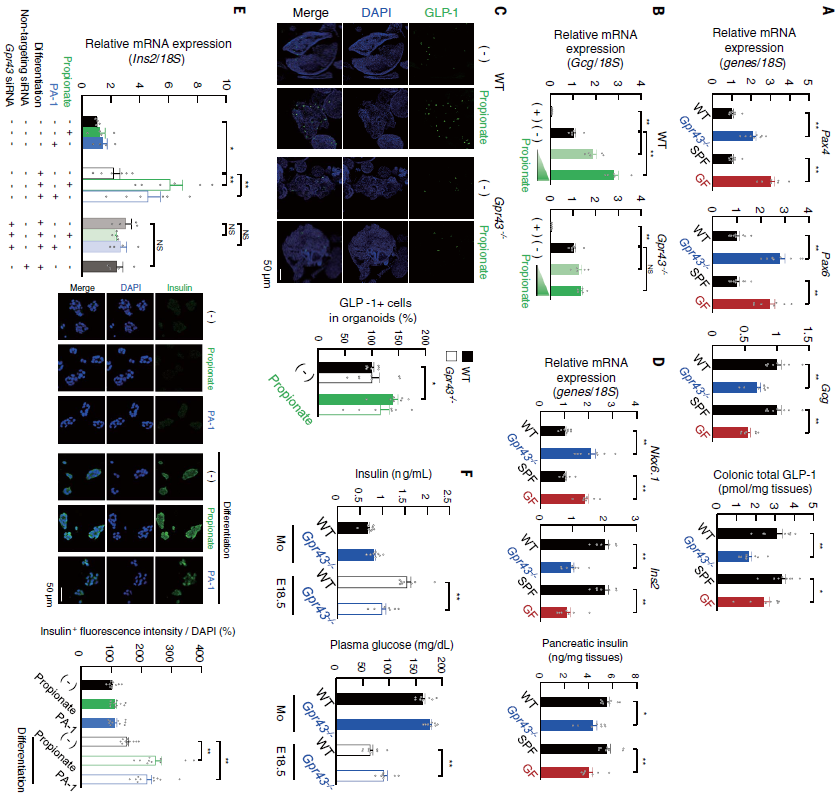
图4 丙酸通过胚胎GPR43促进肠内分泌和胰腺β细胞分化
为了进一步证明SCFAs在肥胖抵抗的发育起源中的重要性,作者进行了一项饮食干预研究,在常规条件下给怀孕的ICR小鼠喂食高纤维(HFi)或低纤维(LFi)饮食,然后检查其后代对肥胖的易感性。结果发现HFi摄入抑制了HFD引起的体重增加,但当给怀孕小鼠使用抗生素时,HFi饮食的效果被取消,这表明膳食纤维的微生物发酵有助于抑制肥胖。与LFi后代相比,HFi后代血浆代谢参数,能量消耗,交感神经功能障碍如体温降低和心率波动也有改善。孕鼠和胚胎血浆样本的代谢组学分析显示,LFi-和HFi-喂养组之间分别有11和4种代谢物发生了显著变化,其中4种代谢物在HFi-喂养的孕鼠及其胚胎中普遍增加。在这4种代谢产物中,SCFAs是SPF与GF和LFi与HFi比较中的唯一共同因素。HFi喂养小鼠的胚胎中SCFAs水平显著高于LFi喂养小鼠。此外,HFi胚胎的血浆胰岛素水平显著高于LFi胚胎,血浆葡萄糖水平显著降低。因此,母体肠道微生物群通过发酵膳食纤维产生的SCFAs通过母体循环提供给胚胎,改善胎儿葡萄糖稳态,并赋予后代对肥胖的抵抗力(图5)。
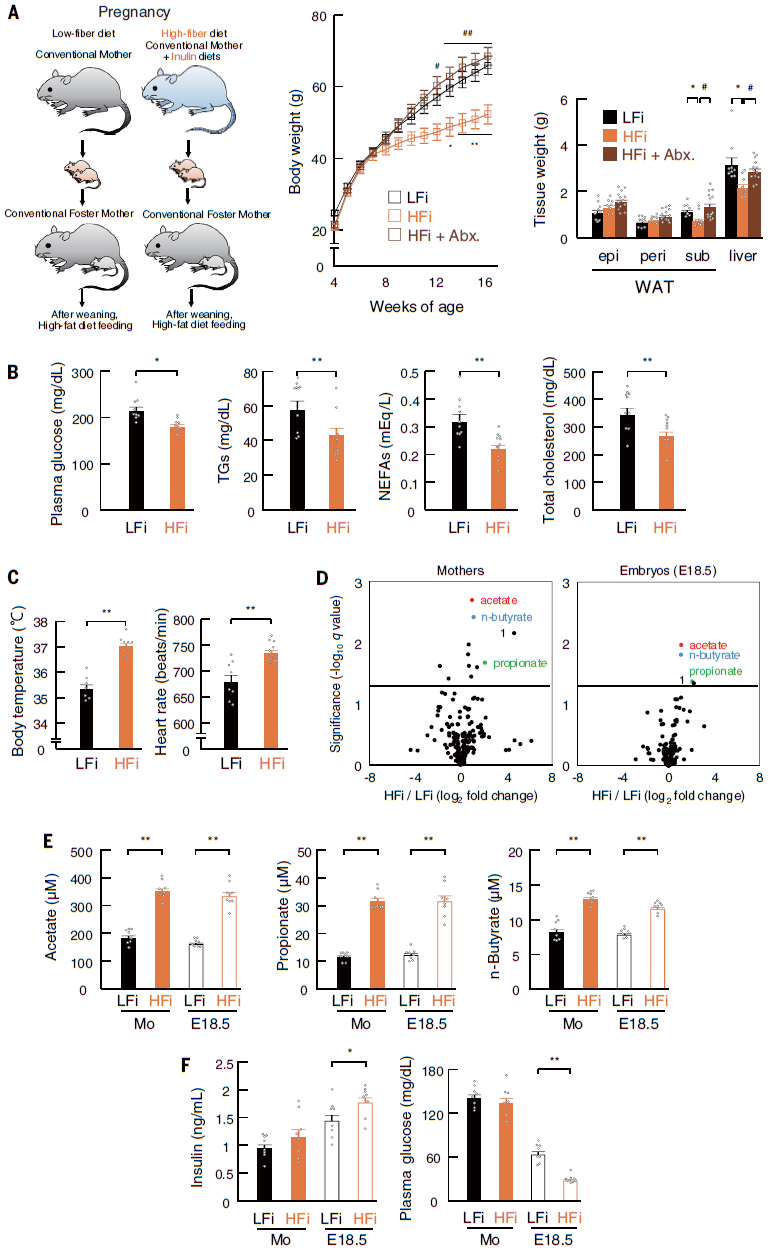
图5 孕鼠补充膳食纤维可使后代对肥胖产生抵抗力
考虑到HFi胚胎血浆丙酸水平可能足以激活GPR41和/或GPR43受体,而且正电子发射断层扫描(PET)显示,灌注后40分钟内,结肠腔内C11标记的丙酸盐通过母体肝脏和血流到达胚胎。因此,作者进一步研究丙酸盐在后代肥胖抵抗中的作用,给怀孕的ICR小鼠喂食添加丙酸盐的LFi饮食。这种饮食的摄入提高了孕鼠和胚胎中丙酸的血浆水平。丙酸处理抑制了HFD引起的成年后代体重、肾周或皮下WAT质量和肝脏重量的增加。与对照LFi后代相比,丙酸处理的孕鼠后代的血浆代谢参数、HFD诱导的葡萄糖耐受不良和胰岛素抵抗、能量消耗及LFi子代的交感神经功能障碍得到改善。此外,母体丙酸的干预可以逆转LFi喂养的孕鼠胚胎中交感神经向心脏投射的阻滞,以及GLP-1+肠内分泌细胞和胰腺β细胞分化的阻滞;还可以提高胚胎中的血浆胰岛素水平,恢复到与HFi胚胎相当的水平。与接受抗生素治疗的HFi喂养的孕鼠的后代一致,HFi喂养的GF-ICR孕鼠的后代再现了肥胖倾向的表型,并在孕期给予丙酸盐予以挽救。这些结果确定了孕期补充丙酸盐可使后代对肥胖有抵抗力(图6)。
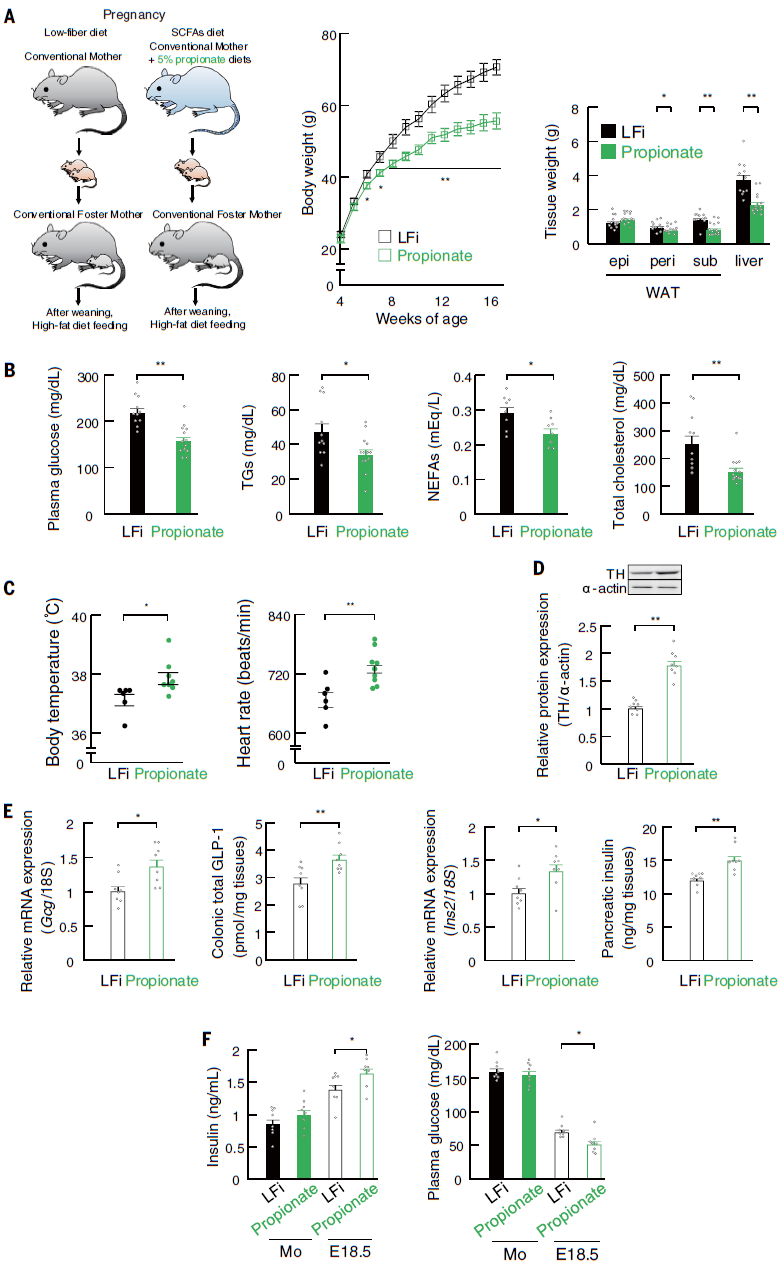
图6 孕鼠补充丙酸盐可导致后代对肥胖的抵抗力
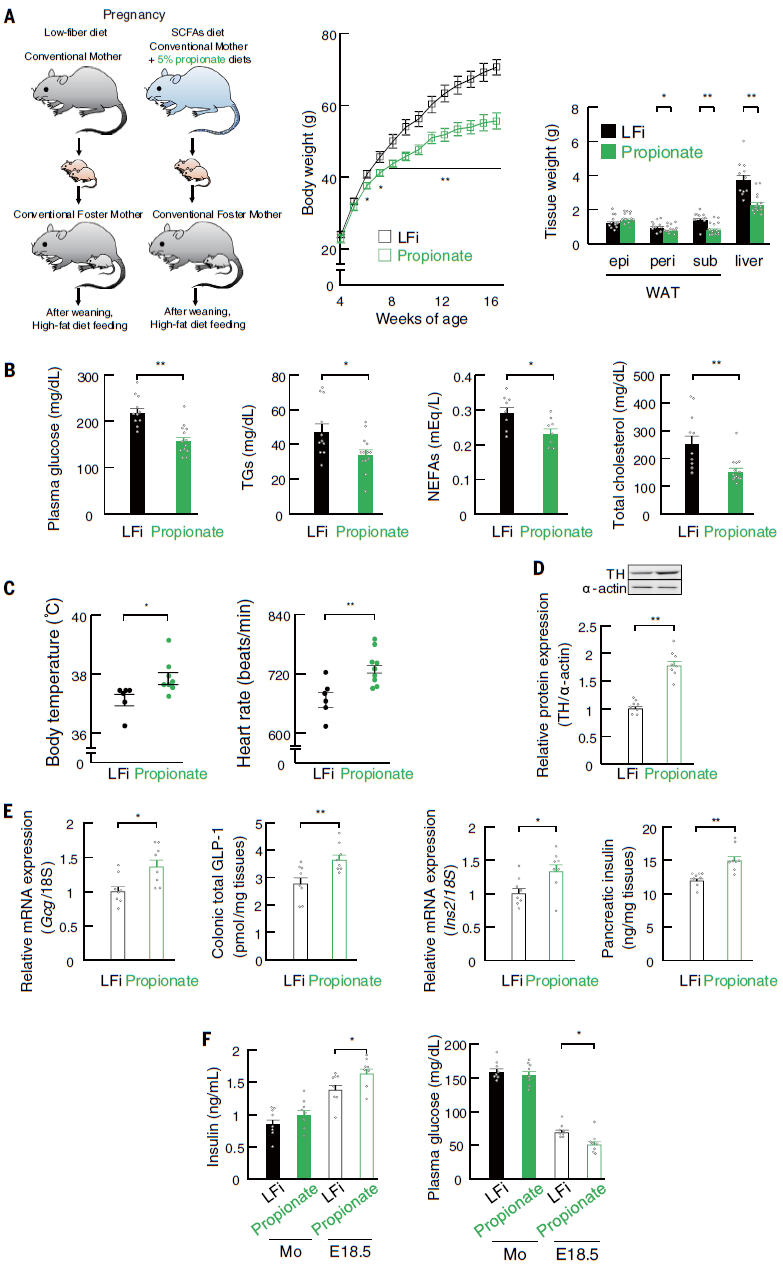
图7 总结图 | 在怀孕期间,母体肠道菌群通过胚胎的SCFA受体影响后代的肥胖趋势
总结
1.在高脂饮食喂食下,GF孕鼠的后代比SPF孕鼠的后代更易患代谢综合征,且喂食低纤维(LFi)饮食的孕鼠后代中也有类似的表型。
2.孕期小鼠结肠腔内的SCFAs通过母体肝脏和血流到达胚胎,作用于胚胎交感神经上的受体GPR41以及肠上皮和胰腺上的GPR43,促进神经细胞、GLP-1+肠内分泌细胞和胰岛β细胞的分化,从而影响了后代甚至成年后能量代谢的发展。
3.通过孕期补充高纤维膳食,以及给GF或LFi喂养的孕鼠补充丙酸,从而使后代对肥胖具有抵抗力。
参考文献:
Ikuo Kimura, Junki Miyamoto, Ryuji Ohue-Kitano,et al. Maternal gut microbiota in pregnancy influences offspring metabolic phenotype in mice.[J].Science 2020 02 28;367(6481)
转载于 Biotree 阿趣代谢





 浙公网安备33010802007965号
浙公网安备33010802007965号