基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。
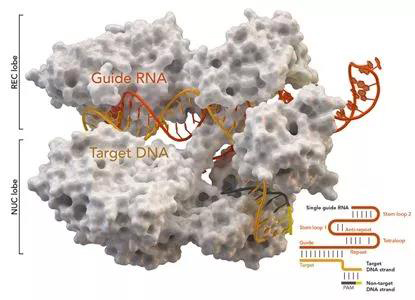
图片来自Thomas Splettstoesser (Wikipedia, CC BY-SA 4.0)
2018年11月26日,中国科学家贺建奎声称世界上首批经过基因编辑的婴儿---一对双胞胎女性婴儿---在11月出生。他利用一种强大的基因编辑工具CRISPR-Cas9对这对双胞胎的一个基因进行修改,使得她们出生后就能够天然地抵抗HIV感染。这也是世界首例免疫艾滋病基因编辑婴儿。这条消息瞬间在国内外网站上迅速发酵,引发千层浪。有部分科学家支持贺建奎的研究,但是更多的是质疑,甚至是谴责。
即将过去的11月份,有哪些重大的CRISPR/Cas研究或发现呢?小编梳理了一下这个月生物谷报道的CRISPR/Cas研究方面的新闻,供大家阅读。
Adv Mater:基因“剪刀”可用于诊断疾病
doi:10.1002/adma.201905311
CRISPR/Cas技术不仅可以改变基因:根据弗莱堡大学的一项研究,通过使用所谓的基因剪刀,可以更好地诊断癌症等疾病。在这项研究中,研究人员介绍了一种微流控芯片,该芯片可识别RNA的小片段,从而比目前可用的技术更快,更准确地指示特定类型的癌症。该结果最近发表在科学杂志“ Advanced Materials”上。

图片来源:Www.pixabay.com。
他们对从四个被诊断出患有脑肿瘤的孩子的血液样本中测试了CRISPR生物传感器的性能。文章作者,弗莱堡微系统工程师Can Dincer博士解释说:“我们的电化学生物传感器的灵敏度比其他使用CRISPR/Cas进行RNA分析的应用高五到十倍。”
CRISPR生物传感器的工作原理如下:将一滴血清与反应溶液混合,然后滴到传感器上。如果它包含靶RNA,则该分子与溶液中的蛋白质复合物结合并激活基因剪刀-类似于打开门锁的钥匙的方式。如此激活后,CRISPR蛋白切断或切割与信号分子连接的报告RNA,从而产生电流。切割导致电流信号的减少,该电流信号可以电化学方式测量并指示样品中是否存在所寻求的miRNA。Dincer解释说:“我们的系统的特殊之处在于它无需复制miRNA就可以工作,因为在这种情况下,将需要专用的设备和化学药品。这使我们的系统成本低廉,并且比其他技术或方法要快得多。”
Nat Biotechnol:科学家成功利用CRISPR技术实现剂量依赖性的基因表达激活
doi:10.1038/s41587-019-0296-7
近日,一项刊登在国际杂志Nature Biotechnology上的研究报告中,来自北卡罗来纳大学Eshelman药学院等机构的科学家们通过研究开发了一种新方法,能够利用CRISPR基因编辑技术进行剂量依赖性的基因表达激活,文章中,研究人员描述了如何利用这种技术以一种可替换的方法来改变基因表达以及其工作的原理和机制。
此前研究结果表明,CRISPR/Cas9基因编辑技术能抑制或激活基因的表达,但截至目前为止,其并不能用来促进剂量依赖性的基因表达激活;这项研究中,研究人员就发现了一种新方法,其能利用化学表观遗传修饰物(CEMs,chemical epigenetic modifiers),通过使用部分内源性染色质-激活器来激活所需的基因进行表达,这或许就能消除外源性转录激活剂的必要性。
研究者发现的新方法包括两种组分,其中第一种就是Cas9,其能与结合蛋白FKBP一起催化失活;第二种就是利用FK506制造的CEM,其能与特殊的分子相关联,而这种分子则能与所需的细胞表观遗传机器相互作用;具体地说,这种新方法能够制造激活CEM的分子,而该分子能帮助寻找基因激活机器,包括CEM114、CEM87和CEM88,诸如此类分子能与不同的酶类相结合,上述两个组分能被用来以研究者需要的方式激活基因的表达。
美国科学家首次在国内利用CRISPR基因编辑技术治疗癌症患者
新闻来源:Doctors try CRISPR gene editing for cancer, a 1st in the US
近日,来自美国的科学家们首次尝试使用基因编辑工具—CRISPR来治疗癌症患者,截至目前为止,接受治疗的3名患者似乎是安全的,目前研究人员还无法确定是否能够利用CRISPR来提高癌症患者的生存率。
临床医生利用来自患者机体的免疫细胞,对其进行遗传改造来帮助患者机体识别并抵御癌症,同时给患者带来的副作用较小;这种基于CRISPR技术的疗法能有效剔除患者机体的三个基因,这些基因能够阻挡患者机体的免疫细胞攻击癌细胞;来自宾夕法尼亚大学的研究者Edward Stadtmauer表示,这是迄今为止我们尝试过的最复杂的基因和细胞工程技术操作,如今研究证据表明,我们能够安全地对患者机体的免疫细胞进行基因编辑。
研究者表示,2-3个月后,一名患者的病情继续出现了恶化,另外一名患者的病情则相对稳定,由于第三名患者接受治疗的时间较短,研究人员并不清楚其后期的疾病进展状况,研究者计划再对15名患者进行治疗,并评估治疗的安全性和疗效;目前针对其它血液癌症的细胞疗法已经取得了很大的成功,其治愈了很多无法治愈的疾病,而基因编辑为改善这些疾病的治疗也提供了一定的希望。基因编辑技术能永久性地改变DNA从而阻断疾病根源,CRISPR是一种能在特异性位点切断DNA的工具,长期以来科学家们一直在实验室使用该工具来治疗其它疾病。
这项研究中,研究人员目的并不在于改变个体机体的DNA,而是试图通过改变患者机体的DNA来给予其强大的抗癌能力(另外一种免疫疗法)。有报道显示,中国科学家已经在癌症患者机体中开展了这样的试验,但这项研究是首次在国外进行这样的研究报道,其如此新颖以至于需要得到美国监管机构花费两年时间才能得到批准。目前这项临床试验的早期结果由美国血液学会公布,具体细节将会12月的年会上进行公布。
参与该项临床试验的三名患者中有两名是多发性骨髓瘤(一种血液癌症)患者,另一名为肉瘤患者,所有患者接受多种标准化疗法均没有效果,并没有更好的治疗选择。研究者将患者的血液提取过滤来取出T细胞,并在实验室中进行改造重新输注回患者体内,研究者旨在对患者进行一次性治疗,这些细胞能够在患者体内重新繁殖并且充当一种活体药物对癌细胞进行攻击。
Nature:新型CRISPR工具或能通过将RNA复制到基因组中精确修饰基因
doi:10.1038/d41586-019-03392-9
构成生命蓝图的DNA序列变异对任何物种的健康都是至关重要的,成千上万的DNA突变被认为都会导致疾病,经过几十年的遗传学和分子生物学研究后,如今研究人员在开发能够纠正突变的基因组编辑工具上取得了巨大的进展,但由于工具依赖于复杂和相互竞争的细胞过程,基因编辑的效率和准确性似乎受到了根本性的限制;近日,一项刊登在国际杂志Nature上的研究报告中,研究者Anzalone等人描述了一种“查找并替换”(search-and-replace)的基因组编辑技术,即将两种分子机器相结合来精确改变基因组,该技术对于生物医学科学研究具有直接且深远的影响。
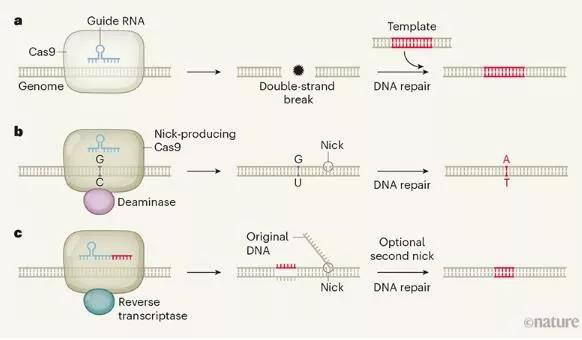
图片来源:Randall J. Platt. doi: 10.1038/d41586-019-03392-9
这种名为prime编辑(prime editing)的基因组编辑技术依赖于一种混合分子机器,其包括一个改良版本的Cas9,其仅切割两条DNA链中的一条,和一个转录酶,同时会在切割位点装载新的和可定制的DNA;这种组合与酵母中自然发生的过程非常相似,在酵母中,与RNA序列相对应的DNA会通过逆转录酶整合到基因组中去。
prime编辑能被一种工程化、由两部分组成的向导RNA(gRNA)进行调节,gRNA中的“寻找”部分会指导Cas9进入到DNA靶点的特殊序列,从而对其中一条DNA链进行切割,随后,逆转录酶会在gRNA的“替换”部分上产生与该序列互补的DNA,并将其装载在两个被切割的DNA末端中的一个上,从而取代原来的DNA序列。
此时,被修饰的双链DNA会由两条不互补的链组成,即被编辑过的链和未被Cas9切断的完整链,非互补序列在细胞中是不被容忍的,其中一个链必须通过DNA的修复过程来固定从而匹配另外一个链,而完整的链则通常会被优先保留;因此作者通常必须使用第二种RNA向导来指导对完整链的切割,从而增加修复该链以匹配编辑序列的机会;研究者通过高效精确地将大量序列引入到DNA中,从而展示了prime编辑的多功能性,比如,研究人员在人类胚胎肾细胞中使用该技术来纠正产生血液镰刀细胞病的突变,同时还能对引发神经性Tay-Sachs病的突变进行编辑,这几乎完全避免了不完美的编辑,同时研究者还在体外对人类癌细胞和小鼠神经元进行了编辑。
尽管如此,prime编辑技术也尤其局限性,发生在prime编辑组分之间的复杂、多步分子“舞蹈”还无法被预测,而且其并不总是会如预期那样出现;因此仍然可能出现不完全的随机编辑,这意味着研究人员可能需要测试几个组分的不同组合,从而确定每个感兴趣编辑所需要的编排方式;其次,将大型的prime编辑系统引入到特定的细胞类型中非常具有挑战性,因为之前许多尝试都在Cas9系统中失败了。
Vertex揭示了在首批接受CRISPR/Cas9基因编辑疗法患者中激动人心的数据
新闻来源:Vertex reveals promising data from first CRISPR-treated patients
Vertex及其合作伙伴CRISPR Therapeutics公布了其CRISPR/Cas9基因编辑疗法CTX001治疗的前两名患者的初步阳性数据。令人印象深刻的数据表明,这两名患有严重血红蛋白病,分别为依赖输血的β地中海贫血(TDT)和严重的镰状细胞病(SCD)的患者很可能可以通过该疗法被治愈。
TDT患者于2019年第一季度接受了CTX001,该患者的数据反映了9个月的安全性和有效性随访。在参加研究之前,TDT患者每年需要输血16.5次。在CTX001治疗的9个月间,患者是不进行输血的,总血红蛋白水平为11.9g/dL,10.1g/dL胎儿血红蛋白和99.8%的F细胞。
在参加研究之前,SCD患者每年经历7次血管闭塞危机(VOC)。CTX001输注后四个月,患者无VOC,总血红蛋白水平为11.3g/dL,胎儿血红蛋白为46.6%,F细胞为94.7%。
但是,两名患者在用CTX001治疗期间均出现了副作用,但主要研究者并未将这些不良事件视为与研究治疗有关。副作用被认为与接受CRISPR治疗的准备有关,患者必须先接受化疗以破坏其旧的骨髓细胞,这可能会引起不良事件。
Vertex首席执行官Jeffrey Leiden说:"我们今天宣布的数据令人瞩目,并证明CTX001有潜力成为镰刀状细胞病和β地中海贫血患者基于CRISPR/Cas9的治愈性基因编辑疗法。"
Nat Commun:如何利用“DNA修复错误”机制治疗疾病?
doi:10.1038/s41467-019-12829-8
近日,由日本京都和加拿大蒙特利尔的研究人员开发的一种新的生物信息学工具MHcut揭示,DNA损伤的自然修复系统——“微同源性介导的末端连接”,在人类细胞中发生的几率可能比以往人们认为的要普遍得多。研究人员使用MHcut和商业基因组编辑技术,以极高的精确度在ips细胞中创建了突变,从而无需患者样本即可对疾病进行建模。因此,即使在患者样本稀少或无法获得的情况下,也将使疾病的研究变得更加容易。相关结果发表在《Nature Communications》杂志上。
通过使用MHcut基因分析工具。Janin Grajcarek发现人类基因组中所有缺失突变的57%都位于微同源序列(至少三个碱基对)的两侧,这一数字比预期大得多。Grajcarek相信,这些缺失将使人们对基因组功能产生新的见解。
当下流行的基因编辑技术(例如CRISPR / Cas9)是通过利用天然DNA修复系统(例如非同源末端连接,同源性定向修复和MMEJ)进行操作。Woltjen的团队在较早的工作中表明,MMEJ相比其他系统提供了更高的精度。在MHcut的帮助下,这项新研究向科学家展示了如何在人类基因组中鉴定通过MMEJ重建的缺失突变。
7.俄罗斯科学家已在人类卵子中开展旨在校正耳聋基因突变的基因编辑实验
新闻来源:Russian ‘CRISPR-baby’ scientist has started editing genes in human eggs with goal of altering deaf gene
俄罗斯生物学家Denis Rebrikov已开始对具有正常听力的女性捐赠的卵子进行基因编辑,以了解如何让一些聋哑夫妇生下没有携带损害听力的基因突变的孩子。这个消息在他于今年10月17日发送给Nature期刊的电子邮件中有详细说明。它是今年6月份开始的一系列事件中的最新一起,当时Rebrikov告诉Nature期刊他有意利用流行的CRISPR工具制造出抵抗HIV感染的基因编辑婴儿,当然这一意图备受争议。
Rebrikov的这封最新电子邮件是在今年9月俄罗斯杂志N+1上发表的一篇报道之后发送的。该报道称,一对聋哑夫妇已经开始了采卵程序,所获得的卵子将被用来制造一个基因编辑婴儿,不过Rebrikov已进行过基因编辑的卵子来自没有携带损害听力的基因突变的女性。他说,这些实验的目的是更好地了解潜在有害的“脱靶”突变,这是使用CRISPR-Cas9对胚胎进行基因编辑所面临的一种已知的挑战。
Rebrikov在他发送给Nature期刊的电子邮件中明确表示,他尚不打算制造这样的一个婴儿。此前有报道称,他计划在今年10月申请在女性体内植入基因编辑胚胎,但是这一计划已被推迟。
不过,他说他将很快公布其卵子实验的结果,这些实验涉及测试利用CRISPR修复从携带与耳聋相关的GJB2基因突变的人身上获得的体细胞中这种基因突变的能力。如果没有采取干预措施(比如使用助听器或人工耳蜗),那么携带具有两个GJB2突变拷贝的人将听不到声音。Rebrikov说,这些结果将为临床研究打下基础。
转载于towersimper 生物谷





 浙公网安备33010802007965号
浙公网安备33010802007965号